
Veterinaria (Montev.), 56 (213), Ene-Jun 2020, e20205621303
Articulo original
Laureana De Brun1* 0000-0002-3331-9566
Valeria da Silva2 0000-0002-8990-9100
Cecilia Castro1 0000-0002-4026-117
Lucía Rivero2 0000-0002-9716-4364
Marcos Mionetto1 0000-0002-6999-2031
Federico Rodríguez1 0000-0002-4076-289X
Fabrício Campos3 0000-0002-5948-472X
Rodrigo Puentes4 0000-0002-4618-9721
1 Área de Bacteriología, Departamento de Ciencias Microbiológicas, Facultad de Veterinaria, Universidad de la República (UdelaR), Lasplaces 1550, Montevideo, Uruguay. *Email: : laureanadebrun@gmail.com
2 Área de Inmunología, Departamento de Ciencias Microbiológicas, Facultad de Veterinaria, Universidad de la República (UdelaR), Uruguay.
3 Laboratório de Bioinformática e Biotecnologia, Universidade Federal do Tocantins, Campus de Gurupi, Brasil.
4 Área de Virología, Departamento de Ciencias Microbiológicas, Facultad de Veterinaria, Universidad de la República (UdelaR), Montevideo, Uruguay.
El herpesvirus bovino 4 (BoHV-4) es un gammaherpesvirus distribuido mundialmente.
Se ha aislado tanto de animales sanos como enfermos con afecciones respiratorias,
vulvovaginitis, mastitis, abortos y endometritis. Realiza infección latente
en células monocíticas y del sistema nervioso periférico y/o
central. La baja eficiencia reproductiva es un problema identificado en la ganadería
uruguaya. Los agentes virales con impacto reproductivo identificados en el país
incluyen el virus de la rinotraqueítis infecciosa bovina (herpesvirus bovino
1, BoHV-1) y el virus de la diarrea viral bovina (BVDV). Teniendo en cuenta
que países de la región han puesto en evidencia la presencia de BoHV-4
y la posible relación de este virus con problemas reproductivos, el objetivo
de este estudio fue explorar la presencia de BoHV-4 en rodeos de bovinos lecheros
de Uruguay. Se utilizó ELISA comercial para detectar anticuerpos específicos
contra BoHV-1, BoHV-4 y BVDV y PCR para confirmar la presencia de ADN de BoHV-4,
realizando posteriormente la secuenciación genética. Se utilizaron
597 muestras de suero de vacas Holando de los departamentos de Florida, Durazno
y Tacuarembó. Del total, 195 (32,7%) tuvieron anticuerpos para BoHV-4,
285 (47,7%) para BoHV-1 y 564 (94,4%) para BVDV. Se detectó el ADN de BoHV-4
en 13/17 muestras. El alineamiento del árbol filogenético demostró
un alto nivel de identidad (97,2%) entre las cepas uruguayas y de otros países.
Esta representa la primera comunicación de la detección de BoHV-4
en Uruguay. Estudios futuros deben evaluar la diseminación del virus en
la población bovina y su eventual impacto en la salud y producción
ganadera nacional.
Palabras claves: Gammaherpesvirus, PCR,
Rumiantes, Serología.
Bovine herpesvirus type 4 (BoHV-4) is a gammaherpesvirus worldwide distributed.
It has been isolated in healthy and unhealthy animals with respiratory infections,
vulvovaginitis, mastitis, abortions and endometritis. The persistent infection
of BoHV-4 happens in monocytic cells and tissues that are part of peripherical
and/or central nervous system. The reduced reproductive efficiency and the low
index of procreation are the main problems in the Uruguayan breeding cattle.
Reproductive tract infections include two main viruses identified in the country,
infectious bovine rhinotracheitis (IBR) virus (bovine herpesvirus type 1, BoHV-1)
and bovine viral diarrhea virus (BVDV). In some countries of the region have
been evidenced the presence of BoHV-4 and your possible relationship with reproductive
problems. Thus, the main aim of this study is to detect the presence of BoHV-4
in Uruguayan dairy herds. Commercial ELISA were used to detected BoHV-4, BoHV-1
and BVDV antibodies. PCR was used to detect the presence of BoHV-4 DNA and the
products were confirmed by Sanger sequencing. Were used 597 samples of Holstein
cattle from Florida, Durazno and Tacuarembó provinces. A total of 195 (32.7%)
were positive to BoHV-4, 285 (47.7%) to BoHV-1 and 564 (94.4%) to BVDV antibodies.
To BoHV-4 DNA, 13 of 17 samples were positives. The alignment to phylogenetic
analysis showed a high degree of similarity (97.2%) among Uruguayan and worldwide
strains. This is the first diagnosis of the presence of BoHV-4 in Uruguay. Future
studies must evaluate the dissemination of the virus in the bovine population
and the likely impact it has in the dairy healthy and national milk production.
Keywords : Gammaherpesvirus, PCR, Ruminants, Serology.
Recibido: 26/12/18
Aceptado: 12/12/19
El herpesvirus bovino 4 (BoHV-4), también llamado gammaherpesvirus bovino 4, pertenece a la familia Herpesviridae, subfamilia Gammaherpesviridae, género Rhadinovirus (ICTV, 2018), y ha sido detectado en bovinos con infecciones respiratorias, vulvovaginitis, mastitis, abortos, endometritis e incluso en animales aparentemente sanos (Morán et al., 2015). Se asocia mayoritariamente a infecciones del tracto reproductivo de los bovinos, particularmente durante el periodo posparto (Chastant-Maillard, 2013). Estudios epidemiológicos indican que la seroprevalencia de BoHV-4 es significativamente mayor en hembras que abortan y en hembras que manifiestan repetición de celos, que en aquellas que no presentan estos signos (Kale et al., 2011; Motta et al., 2013), sugiriendo que la exposición al agente podría tener un impacto negativo en la eficiencia reproductiva. BoHV-4 se ha detectado en tejidos de fetos bovinos abortados esporádicamente (Delooz et al., 2017). Existen estudios que asocian el BoHV-4 con infertilidad en hembras o el desarrollo de enfermedades en el tracto reproductivo en el posparto, ya sea solo o en coinfección con otros patógenos (Monge et al., 2006; Welchman et al., 2012; Areda et al., 2018).
BoHV-4 puede transmitirse por vía horizontal y vertical. La primera ocurre por contacto directo e indirecto mediante secreciones y fómites. Las secreciones nasales, orales o genitales representan fuentes de infección para otros animales. La multiplicación primaria del BoHV-4 se lleva a cabo dentro de las células epiteliales de las mucosas nasales, orales y genitales, luego el virus se disemina dentro del organismo en macrófagos y linfocitos. Durante la fase aguda de la infección el virus se replica en los linfocitos, ocurriendo la multiplicación masiva 7-8 semanas postinfección. Como otros herpesvirus, el BoHV-4 presenta capacidad para establecer latencia, siendo las células de la línea linfoide el principal sitio de latencia para los gammaherpesvirus, pudiendo además alojarse en los ganglios de los nervios trigéminos (Campos et al., 2014). Los hospedadores latentemente infectados son fuentes potenciales de transmisión viral para el rebaño y pueden excretar el virus ante condiciones de estrés, infecciones intercurrentes, el transporte o la administración de glucocorticoides (Morán et al., 2015).
En países de Sudamérica, el virus ha sido detectado desde hace varios años. En Argentina se detectó por primera vez en 2007 en mucus cérvico-vaginal de vacas que abortaron (Verna et al., 2008), y desde entonces el número de animales infectados detectados ha ido en aumento, existiendo actualmente más de 40 aislamientos de BoHV-4 en este país (Morán et al., 2015). En Brasil, Costa et al. (2011), en el estado de Minas Gerais reportaron casos de BoHV-4 en terneros con signos neurológicos, en siete de diez de las regiones de dicho estado, lo que sugiere que el virus está extendido en la zona. Otros autores, en el estado de Paraná aislaron BoHV-4 en una de cuatro muestras de hisopado de descargas vaginales extraídas de hembras con antecedentes de aborto (Krüger et al., 2015a) y luego mediante la prueba serológica de ELISA, Krüger et al. (2015b) determinaron que había exposición a BoHV-4 en bovinos de 315 establecimientos de los 13 estados de Brasil que analizaron.
En Uruguay, se estima que las pérdidas reproductivas representan aproximadamente 11 al 12% y los índices de procreo rondan el 70% (Uruguay XXI, 2015). Estos han sido identificados como problemas relevantes en la ganadería de cría a nivel nacional, y a pesar de que pueden deberse a una multiplicidad de causas, los agentes infecciosos con conocido o potencial efecto sobre la reproducción, y en particular los agentes virales, no han sido exhaustivamente explorados. En cuanto a las virosis involucradas en fallas reproductivas diagnosticadas en Uruguay, están el virus de la rinotraqueítis infecciosa bovina (IBRV o herpesvirus bovino 1 -BoHV-1) y el virus de la diarrea viral bovina (BVDV) (Easton, 2006), ambos ampliamente difundidos en los rodeos lecheros nacionales y recientemente se encontró como abortivo en bovinos al virus de parainfluenza 3 (Macias-Rioseco et al., 2019). El BoHV-1 pertenece a la familia Herpesviridae, subfamilia Alphaherpesvirinae, género Varicellovirus. Puede producir infecciones latentes en los ganglios trigéminos, lo cual tiene importancia epizootiológica dado el peligro que representan en la transmisión los animales asintomáticos y serológicamente negativos (Jones et al., 2006). Se han descrito para BoHV-1 una amplia variedad de signos clínicos como consecuencia de su acción sobre los sistemas respiratorio, genital, digestivo y nervioso. El BVDV perteneciente al género Pestivirus de la familia Flaviviridae, es responsable de ocasionar un amplio rango de manifestaciones clínicas y lesiones, siendo los trastornos reproductivos y de inmunosupresión los de mayor impacto económico (Bielefeldt, 1995). Maya et al., 2016 publicaron la primera caracterización genética del BVDV en Uruguay en predios con problemas reproductivos, demostrando que las especies BVDV-1 y -2 circulan en rodeos nacionales, observando supremacía del subtipo BVDV-1a.
La vacunación contra BoHV-1 y BVDV en el país no es obligatoria, pero se realiza desde hace varias décadas. Sin embargo, ambos agentes siguen teniendo una alta seroprevalencia, estimadas en aproximadamente 36% y 77% para BoHV-1 y BVDV respectivamente a nivel individual, y de 99% para BoHV-1 y 100% para BVDV a nivel de establecimientos, lo que sugiere una alta difusión de ambos agentes, dado a la poca implementación de la vacunación en el País en esa época los resultados positivos se atribuyen a anticuerpos generados debido a la exposición natural al virus BoHV-1 y BVDV (Repiso et al., 2005; Guarino et al., 2008). Sin embargo, hasta el momento no se ha evaluado la presencia de BoHV-4 en Uruguay ni su posible impacto en la salud animal. Debido a los diferentes cuadros con los que se ha asociado a este virus, la complejidad del diagnóstico y el interés creciente de investigaciones en las enfermedades reproductivas presentes en el país, es que el propósito de este estudio fue explorar la presencia de BoHV-4 en rodeos lecheros en Uruguay.
Se analizaron un total de 597 sueros bovinos sin antecedentes de vacunación para enfermedades reproductivas, pertenecientes a 42 productores lecheros, distribuidos en dos experimentos que se detallan a continuación.
Se utilizaron 550 sueros bovinos del banco de sueros del Departamento de Ciencias Microbiológicas de Facultad de Veterinaria de UdelaR. Las muestras fueron extraídas por venopunción coccígea y recolectadas en tubos sin anticoagulantes en el año 2009. Las mismas correspondían a ganado Holando multíparo, clínicamente sano, perteneciente a 41 productores de los Departamentos de Florida (4/41), Durazno (27/41) y Tacuarembó (11/41).
Con la finalidad de la determinación del genoma viral del BoHV-4, de un tambo del departamento de Florida con 400 vacas en ordeñe se extrajo muestras de sangre de 47 vacas con antecedentes de metritis posparto, extraídas mediante venopunción coccígea y recolectadas en tubos con y sin anticoagulantes en el año 2016.
A partir de muestras de sangre anticoagulada se extrajo ADN por el método de fenol-cloroformo, el cual se basó en cuatro pasos secuenciales: lisis celular y nuclear, purificación del ADN, precipitación y lavado con etanol, y re-suspensión del ADN (Hughes et al., 1978).
Se analizó la presencia de anticuerpos contra BoHV-1, BoHV-4 y BVDV. Para esto se utilizó un kit comercial de ELISA indirecto marca Bio X Diagnostics (BIO - ABORTION ELISA KIT, Bélgica), en el cual las placas están sensibilizadas con antígenos de los tres virus. Los sueros fueron diluidos 1:100, incubados en las microplacas sensibilizadas con los 3 antígenos diferentes durante una hora a temperatura ambiente. Luego de los lavados, se agregó un conjugado anti-inmunoglobulina bovina unida a peroxidasa, se incubó nuevamente una hora a temperatura ambiente y posterior a lavados se reveló la presencia de anticuerpos mediante una solución cromogénica (TMB- tetrametilbenzidina). La densidad óptica (DO) se determinó en un espectrofotómetro a 450 nm. Para cada muestra se calculó el coeficiente mediante la siguiente fórmula:
Val (ue) = Delta DO Simple / Delta DO positivo * 100
Los resultados se consideraron según la tabla número 1 y se consideró como muestras débilmente positivas las categorías + y ++ (27<=val<=81%).
Tabla 1. Interpretación de resultados serológicos del Kit Bio X Diagnostics (BIO - ABORTION ELISA KIT, Bélgica) para cada antígeno.

Se realizó PCR anidada para la detección del genoma viral en 17 muestras tomadas al azar, siguiendo un protocolo de amplificación descrito por Wellenberg et al. (2001). En este paso se obtuvo un fragmento de 615 pb y luego de la segunda ronda de amplificación, un fragmento de 364 pb del gen que codifica para la glicoproteína B (gB) del BoHV-4 (Campos et al., 2014). Los productos de amplificación se visualizaron en geles de agarosa al 1,5%, teñidos con Good View Nucleic Acid Stain. Como control positivo se utilizó la cepa Movar, gentilmente cedida por el laboratorio de Virología del Instituto de Ciências Básicas da Saúde (ICBS) de la Universidad Federal de Río Grande del Sur (UFRGS) - Brasil. El mismo se utilizó a diferentes diluciones.
Trece productos de amplificación fueron secuenciados en ambos sentidos (Macrogen Inc., Corea) por el método Sanger. La alineación de las secuencias de nucleótidos se realizó utilizando el programa Bioedit versión 2.0 que emplea la aplicación ClustalW. Se construyó un árbol filogenético con el software MEGA 6. Este programa permitió estimar el modelo evolutivo que más se adaptó a los datos obtenidos y construir el árbol filogenético utilizando además cepas de referencia, de Europa, de Argentina y Brasil extraídas del GenBank. La relación evolutiva se estimó utilizando el algoritmo de "vecino más próximo". Las secuencias obtenidas fueron depositadas en el banco de datos del GenBank (Número de acceso: MH799307, MH799308, MH799309, MH799310, MH799311, MH799312, MH799313, MH799314, MH799315, MH799316, MH799317, MH799318, MH799319).
Se realizó un análisis descriptivo de los datos mediante el empleo de Microsoft Office Excel. Se elaboraron planillas donde se identificaron cada una de las muestras con un número y los resultados expresados cómo negativos o positivos, y mediante la prueba de chi 2 se comparó la seropositividad a BoHV-4 según el departamento de origen de las muestras, considerando un valor p<0,05 para establecer diferencias significativas.
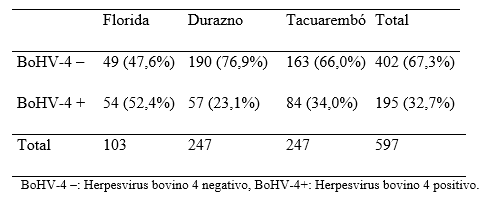
Del total de 597 sueros (experimento 1 y 2), 195 (32,7%) fueron positivos a anticuerpos contra BoHV-4, de los cuales 128 (65,6%) fueron clasificados como "positivos débiles". Por departamento, 34% (84/163) resultó positivo en Tacuarembó, 23% (57/247) en Durazno y 52,4% (54/103) en Florida, habiendo diferencias significativas entre departamentos (Tabla 2).
Tabla 2. Resultados serológicos para BoHV-4 en rodeos lecheros por departamento estudiado
Del total de 597 muestras, 285 (47,7%) fueron positivas a anticuerpos contra BoHV-1, 114/597 (19,1%) fueron positivas a ambos herpesvirus (BoHV-1 y BoHV-4), las 81 muestras restantes de las 195 positivas a BoHV-4, no lo fueron para el BoHV-1. En cuanto al BVDV 564/597 animales fueron seropositivos (94,5%), 170 de los cuales (30,1%) fueron seropositivos a BoHV-4 (Tabla 3).
Tabla 3. Frecuencia de los animales según serología a BoHV-1, BoHV-4 y BVD

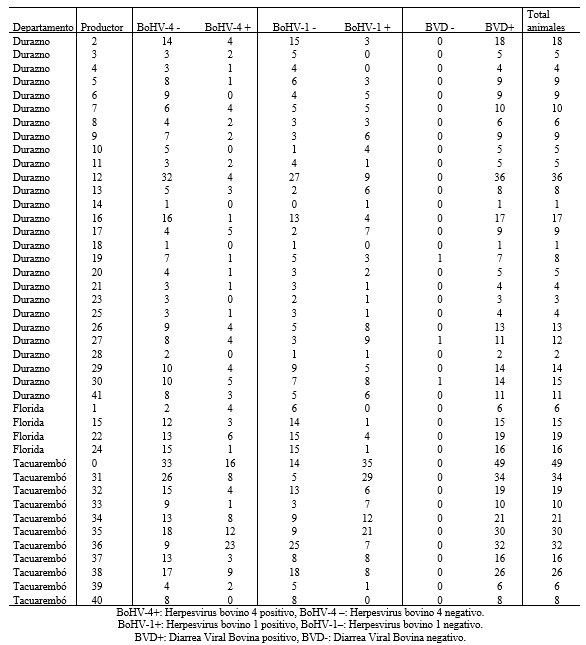
En cuanto a los resultados del experimento 1, de los 550 sueros analizados, se observó que todos productores tenían la mayoría de sus animales seropositivos al BVDV, mientras que para el BoHV-4 siete (7/41) productores (5 de Durazno y 2 de Tacuarembó) no presentaron animales seropositivos para este virus, mientras que los productores de Florida todos tenían algún animal seropositivo a BoHV-4. Para BoHV-1 cinco (5/41) productores no presentaron animales con serología positiva contra este virus (Tabla 4).
Tabla 4. Serología para cada virosis por productor y departamento
De 47 animales del departamento de Florida, correspondientes al experimento 2, 40 (85,1%) fueron seropositivos a BoHV-4. De estas, se eligieron 17 muestras al azar que fueron procesadas mediante PCR anidado para la detección del genoma de BoHV-4, obteniéndose 4 negativos y 13 positivos (Fig. 1). Posteriormente, se enviaron a secuenciar las 13 amplificaciones obtenidas, generando así la filogenia correspondiente a un fragmento del gen gB del BoHV-4. Las 13 secuencias uruguayas fueron comparadas con otras 25 secuencias de BoHV-4, y se utilizó como grupo externo el Macaca mulatta rhadinovirus (Fig. 2). El alineamiento del árbol filogenético demostró un alto nivel de identidad (97,2%) entre las cepas uruguayas y de otros países.
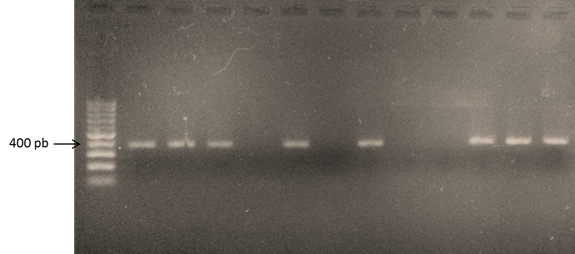
Figura 1. Gel de agarosa al 1,5% de la PCR anidada donde se observa la amplificación del fragmento de 364 pb correspondiente a un fragmento del gen que codifica para la glicoproteína B de BoHV-4. En el carril 1 se observa el marcador de peso molecular de 100 pb, en los carriles 2, 3, 4, 6 y 8 se observan 5 muestras positivas, en los carriles 5, 7 y 9 muestras negativas, en el carril 10 el control negativo (agua ultra pura), en el carril 11 el control positivo a una dilución de 1/100, en el carril 12 el control positivo a 1/500, y en el carril 13 el control positivo a una dilución de 1/1000.

Figura 2. Árbol filogenético del fragmento del gen que codifica para la glicoproteína B (gB) de BoHV-4. Se muestra la relación filogenética de las secuencias de Uruguay (rombo negro) (Número de acceso: MH799307, MH799308, MH799309, MH799310, MH799311, MH799312, MH799313, MH799314, MH799315, MH799316, MH799317, MH799318, MH799319) y cepas de referencia depositadas en el GenBank provenientes de Brasil, Argentina, Turquía, Alemania, Bélgica, EE.UU, Irlanda. El análisis incluyó 38 secuencias de BoHV-4 y como virus externo el Macaca mulatta rhadinovirus.
En Uruguay hasta el momento, se desconocía la situación de BoHV-4 en la población bovina, siendo este el primer reporte de la detección serológica y molecular del virus. En diferentes partes del mundo BoHV-4 se ha asociado con una amplia variedad de cuadros clínicos con infecciones respiratorias, vulvovaginitis, mastitis, abortos y endometritis, e incluso se ha identificado en animales sanos (Izumi et al., 2006; Bilge et al., 2012), y en bovinos lecheros con repetición de celo (Kale et al., 2011).
En los países en los que se ha detectado el virus, las prevalencias serológicas encontradas han variado de 16 a 30%, con títulos de anticuerpos neutralizantes de 1:8 a 1:64 (Frazier et al., 2002). En un estudio realizado en Colombia en el año 2013, en el cual se estudiaron 7 predios, encontraron todos los rodeos seropositivos a BoHV-4 y una seropositividad del 72,4% (Motta et al., 2013).
En el presente estudio se detectó un 32,7% de seropositividad a BoHV-4, habiendo uno de los establecimientos con un 85% de los animales estudiados positivos. Del total de muestras analizadas, más del 50% fueron clasificadas como débilmente positivas. Esto concuerda con otros estudios que sugieren que la respuesta inmune humoral del ganado después de la infección BoHV-4 se caracteriza por una escasa producción de anticuerpos neutralizantes con baja avidez (Thiry et al., 1990; Donofrio et al., 2000), pero sí son detectables mediante la técnica ELISA. En cuanto a la posibilidad de que exista reacción cruzada entre BoHV-4 y otros herpesvirus bovinos relacionados, Krüger et al., (2015b) no encontraron reacción cruzada entre anticuerpos específicos contra BoHV-1 y BoHV-4 mediante ELISA. En el presente trabajo el 47,7% (285/597) de los animales fueron positivos a BoHV-1, mientras que 13,6% (81/597) fueron negativos a BoHV-1 y positivos a BoHV-4 y a la inversa, el 28,6% (171/597) de los animales fueron positivos a BoHV-1 y negativos a BoHV-4. Costa et al., (2011) encontraron bovinos coinfectados con BoHV-4 y BoHV-5 mediante la detección de ADN de ambos virus en muestras del sistema nervioso central. Coinfecciones entre BoHV-1 y BoHV-4 también fueron demostradas previamente en ganglios trigéminos (Campos et al. 2014). En cuanto a la seroprevalencia encontrada en este estudio para el BVDV, alrededor de un 95%, supera a las estudios anteriores (Repiso et al., 2005; Guarino et al., 2008; Maya et al., 2016) concordando en que la totalidad de los predios tienen al menos un animal positivo. Por lo tanto con estos resultados, no se puede descartar que los antecedentes de los problemas reproductivos en los establecimientos muestreados, se deban a otras virosis como BoHV-1 o BVDV.
De la filogenia obtenida, se destaca que las cepas de BoHV-4 de Uruguay están agrupadas con otras cepas de la región (Brasil y Argentina), y otros países del mundo como Turquía y Estados Unidos. Esto confirma que la región amplificada es de una región conservada del gen ORF8 que codifica la glicoproteína B. De tal modo que no hubo variación entre las muestras aisladas desde 1981 hasta el presente en diferentes países. Conservándose efectivamente entre los distintos aislados de BoHV-4 en diferentes regiones del mundo. Se debería analizar la importancia de estos hallazgos, ya sea para entender el origen de estas cepas, así como también para evaluar si hay posibles diferencias en cuadros clínicos según las cepas actuantes. En Argentina se encontró una alta variabilidad de cepas aisladas de muestras de vacas que presentaron abortos, resaltándose así el significado de las investigaciones moleculares sobre el papel del virus como agente infeccioso asociado a enfermedad reproductiva en el ganado bovino (Morán et al., 2015). Donofrio et al. (2009) aislaron y secuenciaron BoHV-4 del útero de vacas afectadas con metritis posparto. Otro estudio confirmó en 9 casos analizados, a este virus como potencial causante de aborto (Verna et al. 2012). A pesar de estas observaciones, estudios adicionales, incluyendo reproducciones experimentales, son necesarios para comprender mejor si BoHV-4 tiene un rol causal en los cuadros clínicos con los que se lo ha asociado en estudios observacionales.
Si bien en la actualidad, las enfermedades infecciosas cada día ocupan un papel más importante, en Uruguay existen pocas evidencias de los agentes infecciosos involucrados a nivel reproductivo. En base a esa escasez de información epidemiológica oficial y actualizada y por la falta en muchos casos de un diagnóstico etiológico definitivo, la estrategia más empleada por los productores es la aplicación masiva de vacunas polivalentes en los rodeos bovinos, buscando mejorar el nivel inmunitario de los animales que permita minimizar las pérdidas reproductivas. La justificación de conocer a ciencia cierta los agentes responsables de las fallas reproductivas, se debe a que para algunos agentes como Neospora caninum y en este caso BoHV-4, no existen vacunas comerciales. Por lo tanto, y en caso de que se demuestre que BoHV-4 es un importante agente en Uruguay, se deberían buscar estrategias de prevención y control distintas a la vacunación, teniendo en cuenta que no existe inmunidad cruzada frente a este y otros herpesvirus que sí están en las vacunas reproductivas, como BoHV-1. En base a esto, se considera necesario profundizar los estudios sobre la presencia de BoHV-4 a nivel del rodeo nacional tanto en ganadería de carne como de leche, involucrando además las posibles interacciones con los demás agentes causantes de fallas reproductivas como BVDV, IBRV, Leptospira spp., Neospora caninum, Campylobacter fetus y otros agentes abortivos identificados en el país (Easton, 2006).
En conclusión, este trabajo demuestra por primera vez la presencia de BoHV-4 en bovinos en Uruguay. Se desconoce completamente el eventual rol causal del BoHV-4 en distintos cuadros clínicos y su potencial impacto en la salud animal, lo que deja abierta la discusión sobre la necesidad de profundizar el estudio de esta infección viral.
Este proyecto fue financiado por la Agencia Nacional de Investigación en Innovación (FSSA_X_2014_1_105283 - ANII) y el Programa de Apoyo a la Investigación Estudiantil de la Comisión Sectorial de Investigación Científica (CSIC) de la Universidad de la República.
Agradecemos al Dr. Agustín Furtado por su colaboración y aportes en la redacción de este artículo.
Areda, D., Chigerwe, M., Crossley, B. (2018). Bovine herpes virus type-4 infection among postpartum dairy cows in California: risk factors and phylogenetic analysis. Epidemiol Infect, 146, 904-912.
Bielefeldt, H. (1995). The pathologies of bovine viral diarrhea virus infection. Vet Clin North Am Food Ani Prac, 11, 447-476.
Bilge, S., Alkan, F., Caliskan, E., Yildirim, Y., Oguzoglu, T. C., Can Sahna, K., Burgu, I. (2012). The investigation of the herpesviruses (BoHV-1 and BoHV-4) on the occurrence of the reproductive disorders in dairy cattle herds, Turkey. Rev Méd Vet, 163, 206-211.
Campos, F. S, Franco, A. C., Oliveira, M. T., Firpo, R., Strelczuk, G., Fontoura, F. E., Kul-mann, M. I. R., Maidana, S., Romera, S. A., Spilki, F. R., Silva, A. D., Hubner, S. O., Roehe, P. M. (2014). Detection of bovine herpesvirus 2 and bovine herpesvirus 4 DNA in trigeminal ganglia of naturally infected cattle by polymerase chain reaction. Vet Microbiol, 171(1-2), 182 - 188.
Chastant-Maillard, S. (2013). Impact of bovine herpesvirus 4 (BoHV-4) on reproduction. Transbound Emerg Dis, 62(3), 245 - 251.
Costa, E., Vasconcelos, A., Bomfim, M., Amorim, H., Lima, G., Coelho, F., Resende, M. (2011). Neurological disorder in cattle associated with bovine herpesvirus 4. Arq Bras Med Vet Zootec, 63, 828-835.
Delooz, L., Czaplicki, G., Houtain, J. Y., Dal Pozzo, F., Saegerman, C. (2017). Laboratory Findings Suggesting an Association Between BoHV-4 and Bovine Abortions in Southern Belgium. Transbound Emerg Dis, 64, 1100-1109.
Donofrio, G., Flammini, C., Scatozza, F., Cavirani, S. (2000). Detection of bovine herpesvirus 4 (BoHV-4) DNA in the cell fraction of milk of dairy cattle with history of BoHV-4 infection. J Clin Microbiol, 38, 4668-71.
Donofrio, G., Franceschi, V., Capocefalo, A., Cavirani, S., Sheldon, I. M. (2009). Isolation and characterization of bovine herpesvirus 4 (BoHV-4) from a cow affected by post-partum metritis and cloning of the genome as a bacterial artificial chromosome. Reprod Biol Endocrinol, 7, 83.
Easton, María Cristina (2006). Estudio patológico de las principales causas infecciosas en el aborto bovino en Uruguay (Tesis de Maestría en Salud Animal). Universidad de la República. Facultad de Veterinaria, Montevideo.
Frazier, K. S., Baldwin, C. A., Pence, M., West, J., Bernard, J., Liggett, A., Miller, D., Hines, M. E. (2002). Seroprevalence and comparison of isolates of endometriotropic bovine herpesvirus-4. J Vet Diagn Invest, 14, 457-462.
Guarino, H., Núñez, A., Repiso, M. V., Gil, A., Dargatz, D. A. (2008). Prevalence of serum antibodies to bovine herpesvirus-1 and bovine viral diarrhea virus in beef cattle in Uruguay. Prev Vet Med, 85(1- 2), 34-40.
Hughes, S. H., Shank, P. R., Spector, D. H., Kung, H. J., Bishop, J. M., Varmus, H. E., Vogt, P. K., Breitman, M. L. (1978). Proviruses of avian sarcoma virus are terminally redundant, co-extensive with unintegrated linear DNA and integrated at many sites. Cell, 15, 1397-1410.
ICTV (2018). International Committee on Taxonomy of Viruses: Taxonomy. Recuperado de: https://talk.ictvonline.org/taxonomy/ (Fecha de consulta: 19/08/2019).
Izumi, Y., Tsuduku, S., Murakami, K., Tsuboi, T., Konishi, M., Haritani, M., Kamiyoshi, T., Kimura, K., Sentsui, H. (2006). Characterization of bovine herpesvirus type 4 isolated from cattle with mastitis and subclinical infection by the virus among cattle. J Vet Med Sci, 68, 189-193.
Jones, C., Geiser, V., Henderson, G., Jiang, Y., Meyer, F., Pérez, S., Zhang, Y. (2006). Functional analysis bovine herpesvirus 1 (BHV-1) genes expressed during latency. Vet Microbiol, 113 (3-4), 199-210.
Kale, M., Ata, A., Kocamüftüoglu, M., Hasircioglu, S. (2011). Bovine herpes virus type 4 (BHV-4) infection in relation to fertility in repeat breeder dairy cows. Act Vet Beograd, 61, 13-19.
Krüger, E., Penha, T., Eira, D., Roehe, P., Ribeiro, M., Soccol, T. (2015a). Bovine herpesvirus 4 in Parana State, Brazil: case report, viral isolation, and molecular identification. Soc Brazileira de Microbiol, 46 (1), 279-283.
Krüger, E. R, Penha, T. R, Hummelgen, F. C., Agottani, J. B, Reva, D., Gonçalves, R., Thomaz-Soccol, V. (2015b). Development and evaluation of an indirect ELISA: Serological survey to detect specific antibodies to bovine herpesvirus 4. Brazilian Arch Biol Technol, 58(5), 725 - 731.
Maya, L., Puentes, R., Reolon, E., Acuña, P., Riet, F., Rivero, R., Cristina, J., Colina, R. (2016) Molecular diversity of bovine viral diarrhea virus in Uruguay. Arch Virol, 161(3), 529 - 535.
Macías-Rioseco, M., Mirazo, S., Uzal, F. A., Fraga, M., Silveira, C., Maya, L., Riet-Correa, F., Arbiza, J., Colina, R., Anderson, M. L., Giannitti, F. (2019). Fetal Pathology in an Aborted Holstein Fetus Infected With Bovine Parainfluenza Virus-3 Genotype A. Vet Pathol, 56(2), 277-281.
Morán, P. E, Pérez, S. E, Odeón, A. C., Verna, A. E. (2015). Herpesvirus bovino 4 (BoHV-4): aspectos generales de su biología y situación en la República Argentina. Rev Argent Microbiol, 47(2), 155-166.
Monge, A., Elvira, L., Gonzalez, J. V., Astiz, S., Wellenberg, G. J. (2006). Bovine herpesvirus 4-associated postpartum metritis in a Spanish dairy herd. Res Vet Sci, 80, 120-125.
Motta, J., García, I., Abeledo, M. A. (2013). Prevalencia de anticuerpos al virus de la diarrea viral bovina, herpesvirus bovino 1 y herpesvirus bovino 4 en bovinos y búfalos en el Departamento de Caquetá, Colombia. Rev Salud Anim, 35 (3), 174 - 186.
Repiso, M. V., Gil, A., Bañales, P., D' Anatro, N., Fernández, L., Guarino, H., Herrera, B., Núñez, A., Olivera, M. A., Osawa, T., Silva, M. (2005). Prevalencia de las principales enfermedades infecciosas que afectan el comportamiento reproductivo en la ganadería de carne y caracterización de los establecimientos de cría del Uruguay. Veterinaria (Montev.) 40, 5-28.
Thiry, E., Dubuisson, J., Bublot, M., Van Bressem. M. F., Pastoret, P. P. (1990). The biology of bovine herpesvirus-4 infection of cattle. Dtsch Tierarztl Wochenschr, 97, 72-77.
Uruguay XXI (2015). Ganadería Bovina. En: Agronegocios (Parte 2, sección 2.3, capítulo 2.3.1.). Recuperado de: http://www.uruguayxxi.gub.uy/informacion/wp-content/uploads/sites/9/2015/06/Informe (Fecha de consulta: 16/11/2017).
Verna, A. E, Leunda, M. R, Louge Uriarte, E. L, Lomónaco, M., Pereyra, S. B., Odeón, A. C. (2008). Primera evidencia virológica de herpesvirus bovino tipo 4 (BoHV-4) en Argentina. Rev Argent Microbiol, 40(1), 53 - 55.
Verna, A. E, Manrique, J. M., Pérez, J., Leunda, M., Pereyra, S. B., Jones, L. R., Odeón, A. C. (2012). Genomic analysis of bovine herpesvirus type 4 (BoHV-4) from Argentina: High genetic variability and novel phylogenetic groups. Vet Microbiol, 160, 1-8.
Welchman, D. D. B., Verkuijl, A. M., Pepper, W. J., Ibata, G., King, S. A., Davidson, H. M., Mawhinney, I. C., Banks, M. (2012). Association of gammaherpesviruses and bacteria with clinical metritis in a dairy herd. Vet Rec, 170, 207-209.
Wellenberg, G. J., Verstraten, E. R. A. M., Belak, S., Verschuren S. B. E., Rijsewijk, F. A. M., Peshev, R., Van Oirschot, J. T. (2001). Detection of bovine herpesvirus 4 glycoprotein B and kinase DNA by PCR assays in bovine milk. J Virol Methods, 97, 101-112.
Notas de contribución:
1. Concepción y diseño del estudio, 2. Adquisición de datos, 3. Análisis de datos, 4. Discusión de los resultados, 5. Redacción del manuscrito, 6. Aprobación de la versión final del manuscrito.
Laureana De Brun ha contribuido en 1, 2, 3, 4, 5 y 6. Valeria da Silva ha contribuido en 1, 2, 3 y 5. Cecilia Castro ha contribuido en 1, 2 y 3. Lucia Rivero ha contribuido en 1, 2 y 3. Marcos Mionetto ha contribuido en 1, 2 y 3. Federico Rodriguez ha contribuido en 1, 2 y 3. Fabricio Campos ha contribuido en 1, 3, 4, 5, 6. Rodrigo Puentes ha contribuido en 1, 2, 3, 4, 5, 6.
El editor Cecilia Cajarville, aprobó ese artículo.