Veterinaria (Montevideo), 2025 61(224), 10.29155/VET.61.224.1
Reporte de caso
Disfunción de la pars intermedia de la pituitaria: estudio de caso
Pituitary pars intermedia dysfunction: case study
Disfunção da pars intermedia da hipófise: estudo de caso
Mateo Pardié1 0000-0002-4100-4994
Camila Guidi1 0009-0004-7562-6144
Amaia Frade1 0009-0004-8026-7270
Agustina Nieves1 0009-0001-5812-6293
Adrián Carzoli2 0000-0003-0994-4326
Paula Pessina2 0000-0002-7809-9026
1Unidad de Clínica y Cirugía de Equinos, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay.
2Laboratorio de Análisis Clínicos, Laboratorio de Endocrinología y Metabolismo Animal, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay. Autor para correspondencia: mapardie@gmail.com
Resumen
La disfunción de la pars intermedia de la pituitaria (PPID; pituitary pars intermedia dysfunction) es un desorden endócrino que se presenta sobre todo en equinos gerontes, sin otra predisposición clara. Los principales signos clínicos son la hipertricosis, la letargia, la laminitis, la pérdida progresiva de peso y la atrofia de masa muscular. En los casos subclínicos se puede observar solamente disminución del rendimiento deportivo e infertilidad, lo que impacta económicamente en la industria. Dado que es una patología subdiagnosticada en Uruguay no existe tratamiento disponible. El objetivo de este trabajo fue reportar el primer caso con diagnóstico definitivo de PPID en un equino en el país.
Palabras clave: Equino, Cushing, Hipertricosis, Pituitaria.
Abstract
Pituitary pars intermedia dysfunction (PPID) is a common endocrine disorder in geriatric horses, affecting equines between 18 and 23 years of age, without any other clear predisposition. The main clinical signs include hypertrichosis, lethargy, laminitis, weight loss and muscle wastage. Its economic impact lies mainly in subclinical cases, which may go unnoticed, causing a decrease in performance, infertility and medical care and treatment expenses aiming to solve these aspects. It is an underdiagnosed pathology in Uruguay and no treatment is available. The purpose of this work is to report the first diagnosed PPID case in this country.
Keywords: Equine, Cushing, Hypertrichosis, Pituitary.
Resumo
A disfunção da pars intermedia da hipófise (PPID, pituitary pars intermedia dysfunction) é um distúrbio endócrino que ocorre principalmente em equinos idosos de 18 e 23 anos, sem outra predisposição clara. Os principais sinais clínicos são a hipertricose, letargia, laminite e perda de peso e massa muscular. O seu impacto econômico reside sobretudo nos casos subclínicos que passam despercebidos, causando diminuição do desempenho, falhas reprodutivas e gastos em cuidados médicos e tratamentos, que visam resolver apenas estes aspectos. É uma patologia subdiagnosticada no Uruguai e sem tratamento disponível. O objetivo deste trabalho é reportar o primeiro caso clínico com diagnóstico definitivo de PPID em um equino no país.
Palavras-chave: Equino, Cushing, Hipertricose, Hipófise.
Fecha de recibido: 12/03/2025
Fecha de aceptado: 02/07/2025
Introducción
La disfunción de la pars intermedia de la pituitaria/hipofisaria (PPID; Pituitary pars intermedia dysfunction), también conocida como síndrome de Cushing equino, se describe como un desorden endócrino frecuente en equinos gerontes, afecta a un 20 % de dicha población (Bertin & Fraser, 2020; Horn et al., 2021).
El término síndrome de Cushing se utiliza para describir al conjunto de signos clínicos atribuidos a una exposición crónica a glucocorticoides (hipercortisolismo o hiperadrenocortisismo). Tiene cuatro posibles causas: alteraciones primarias del hipotálamo-hipófisis asociadas con secreción excesiva de adrenocorticotropina (ACTH), secreción excesiva de glucocorticoides por medio de un adenoma o carcinoma adrenal, secreción de ACTH ectópica por una neoplasia no endócrina y, por último, administración exógena de glucocorticoides. En equinos, el síndrome de Cushing es casi exclusivamente atribuido a PPID (Schott, 2002).
A lo largo de los años ha aumentado la expectativa de vida de los equinos; los que tienen fines deportivos, reproductivos y de compañía llegan a edades más avanzadas y la PPID se vuelve parte de la clínica diaria (Schott, 2002). Hasta el momento no se ha descrito predisposición sexual o racial (Ireland & McGowan, 2018). La edad promedio de los equinos afectados es de 18 a 23 años, lo que sugiere que PPID es una enfermedad de equinos gerontes (Schott, 2002).
La activación del eje hipotálamo-hipófiso-adrenal se da en respuesta a estresores fisiológicos, patológicos o ambientales. Esto involucra la síntesis de hormona liberadora de corticotropina (CRH) por las neuronas dopaminérgicas paraventriculares del hipotálamo, que es secretada hacia el sistema porta hipofisario. Esta estimula a las células corticotropas de la pars distalis que secretan hormona adrenocorticotropa (ACTH). La ACTH actúa en la zona fascicular de las glándulas adrenales estimulando la producción y liberación de glucocorticoides (Kirkwood et al., 2022). La pars intermedia de la hipófisis está compuesta por células llamadas melanotropos, que son directamente inervados por neuronas dopaminérgicas hipotalámicas periventriculares, que liberan dopamina. La dopamina actúa en los receptores D2 de los melanotropos inhibiendo su proliferación celular y transcripción de proopiomelanocortina (POMC). La POMC se cliva para producir ACTH, Kirkwood et al. (2022) establecen que en la hipófisis de un equino normal la mayoría de la ACTH es producida a partir de la POMC, mientras que, además, la POMC se cliva en hormona alfa melanocítica estimulante (α-MSH), beta endorfinas y péptido del lóbulo intermedio semejante a la corticotropina (CLIP).
El estrés oxidativo es considerado una posible causa de PPID y ocasiona neurodegeneración y la consecuente falta de inhibición dopaminérgica de los melanotropos, aumenta así su actividad y resulta en hipertrofia/hiperplasia/adenoma hipofisario (Keen et al., 2004; McFarlane et al., 2005). Huang et al. (2022) determinaron la expresión de un biomarcador de neuronas dopaminérgicas: la tirosina hidroxilasa. Dentro de la pars intermedia se observa una correlación negativa entre los grados de afección histomorfológicos de la hipófisis y la tirosina hidroxilasa, lo que confirma que hay una reducción de la dopamina en la patogénesis de PPID. Por lo tanto, se sugiere que PPID se debe a una reducción de la dopamina y no a una disfunción de los receptores de dopamina D2 (Huang et al., 2022). El aumento de la α-MSH causa hipertricosis, principal hallazgo clínico y patognomónico de PPID, y el incremento de las β-endorfinas produce letargia, este es un signo clínico precoz de la patología (Kirkwood et al., 2022). Otros signos clínicos reportados son pérdida de peso y masa muscular, abdomen péndulo, deposición anormal del tejido adiposo (ectópico), poliuria/polidipsia, hiperhidrosis, infecciones secundarias recurrentes o crónicas, retraso en la cicatrización de heridas, sinusitis, conjuntivitis, gingivitis, infertilidad, galactorrea, desregulación de la insulina, laminitis y anormalidades del casco como seños divergentes (Kirkwood et al., 2022; McGowan et al., 2013; Schott, 2002). Eventualmente se pueden observar signos del sistema nervioso central, como ataxia, ceguera y convulsiones. Aunque se cree que la ceguera se debe a la compresión del quiasma óptico por la hiperplasia de la pars intermedia de la pituitaria, no se encontró relación entre su tamaño y los signos clínicos (Schott, 2002). En un estudio en caninos se observó que la ceguera secundaria a esta patología se debe a alteraciones vasculares y metabólicas a nivel de la hipófisis y no particularmente a su compresión mecánica (Cabrera Blatter et al., 2012).
La recomendación actual para el diagnóstico de PPID clínico es determinar la concentración de ACTH endógena basal, mientras que, para los casos subclínicos, se debe realizar la estimulación con tirotropina (TRH) y consecuente medición de ACTH (Horn et al, 2019; Kirkwood et al., 2022). Dado que la secreción de ACTH varía según la región geográfica y la estación del año —se observa una clara elevación en otoño—, la interpretación de los resultados es difícil. Li et al. (2023) reportaron rangos ajustados a la estación del año.
En la actualidad, el único tratamiento farmacológico efectivo para PPID es la administración oral diaria de mesilato de pergolide, un agonista dopaminérgico que inhibe la secreción de ACTH (Miller et al., 2021). Se recomienda comenzar el tratamiento con 0,002 mg/kg de mesilato de pergolide (1 mg/500 kg) oral cada 24 horas. Se sugiere reevaluar la concentración de ACTH y signos clínicos al mes de haber instaurado el tratamiento para valorar la respuesta a este. Luego, puede reevaluarse mensualmente hasta lograr la dosis adecuada (Kirkwood et al., 2022). El mesilato de pergolide no resuelve la patología pituitaria, sino que controla la mayoría de los signos clínicos (Pease et al., 2011). Para un control más efectivo de la enfermedad se debe realizar un manejo integral (Tatum et al., 2020). Los equinos con PPID se verán beneficiados de una adecuada profilaxis sanitaria, como desparasitaciones, vacunaciones, chequeos dentales, desvasado correctivo, esquila, entre otros métodos orientados al manejo sintomático (McFarlane et al., 2010; McFarlane, 2011; Schott, 2002; Spelta, 2015).
Se relata a continuación un caso clínico de un equino derivado al hospital de la Facultad de Veterinaria, Udelar, donde se determinó la concentración de ACTH endógena y se confirmó el diagnóstico presuntivo de PPID por primera vez en nuestro país.
Materiales y métodos
Caso clínico
Se describe un caso clínico de un equino hembra de raza criolla, de 21 años de edad, derivado a cirugía por posible patología dentaria al Centro Hospital Veterinario de la Facultad de Veterinaria, Udelar, en el mes de noviembre de 2023. El animal se encontraba sin tratamiento hasta su ingreso.
En el examen clínico se observó una condición corporal de 3/9, lo que se considera una condición muy pobre según la escala de Henneke et al. (1983), hipertricosis generalizada, letargia, atrofia muscular, abdomen péndulo, nódulos linfáticos submandibulares aumentados y una fístula con secreción purulenta en la región maxilar izquierda. Al examinar la cavidad oral se observó tabla dentaria acorde a la edad del animal, con acúmulo de alimento impactado alrededor de las piezas 208, 209, 210; formación de bolsas periodontales, y gingivitis. Los demás parámetros del examen clínico se encontraron sin particularidades.

Figura 1: Izquierda: Se muestra la clara hipertricosis generalizada y abdomen péndulo. Derecha: Se observa la evidente atrofia de masas musculares.
Examen radiográfico y toma de muestras
Se tomaron tres radiografías de cráneo: una latero-lateral y dos oblicuas para la visualización de las raíces de los premolares y molares izquierdos.
Se extrajeron 10 ml de sangre de la vena yugular, con agujas 21G. Una submuestra se colocó en un tubo con EDTA para la realización de hemograma; otra en un tubo sin anticoagulante para la realización del funcional hepático, urea y creatinina; otra con fluoruro de sodio para la determinación de la glicemia, y, por último, una en tubo con EDTA refrigerado para la determinación de la ACTH endógena basal. Dado que en Uruguay no se cuenta con valores de referencia propios para la interpretación de ACTH basal, se utilizaron para su interpretación los valores de referencia de Hart et al. (2021) del hemisferio norte, homologando a la estación del año correspondiente. Dada esta dificultad y para respaldar la interpretación de nuestros resultados, se decidió tomar muestras de cuatro equinos adultos sanos en la misma estación del año (primavera) y determinar la concentración de ACTH basal. Las muestras fueron analizadas en el Laboratorio de Análisis Clínicos y Endocrinología y Metabolismo Animal de la Facultad de Veterinaria, Udelar, de forma inmediata, debido a la labilidad de esta hormona.
Resultados
En las radiografías, los senos maxilares se observaron con un aumento de la radiodensidad. Las raíces de las piezas 206 a 211 presentaron apariencia acorde a la edad. Además, se observó la presencia de espacios interproximales en el molar 209.
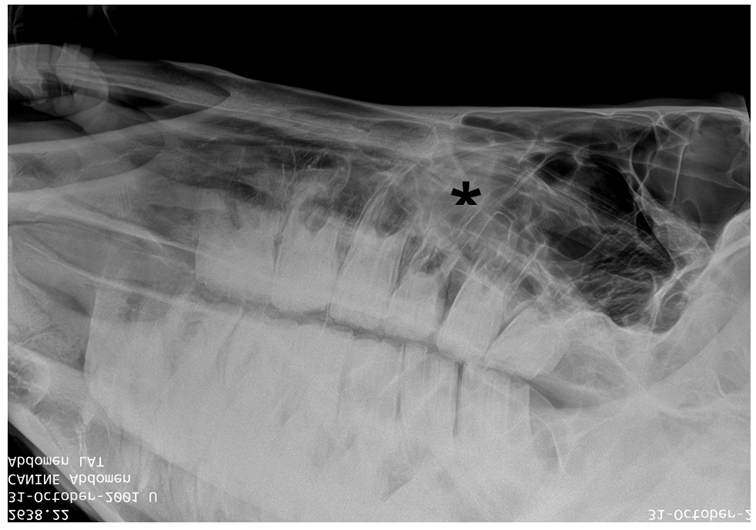
Figura 2: Radiografía de cráneo. Senos maxilares con aumento de la radiodensidad (asterisco*). Raíces de las piezas 206 a 211 de apariencia acorde a la edad. Espacios interproximales en el molar 209.
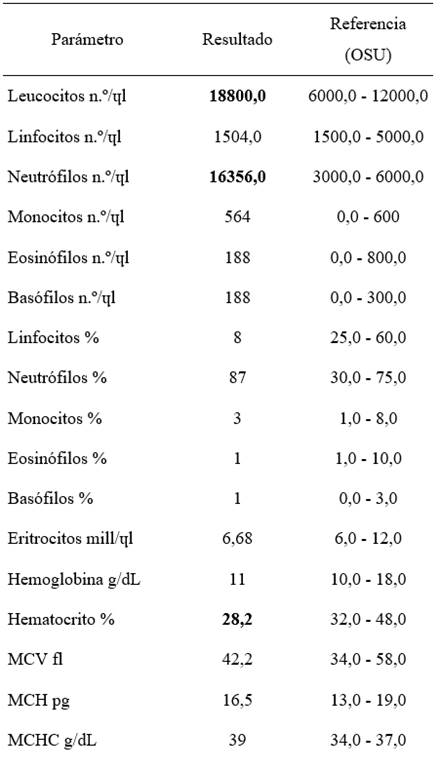
En la analítica sanguínea, el recuento hematológico reveló leucocitosis con neutrofilia y hematocrito levemente disminuido.
Tabla 1: Variables hematológicas del caso clínico reportado
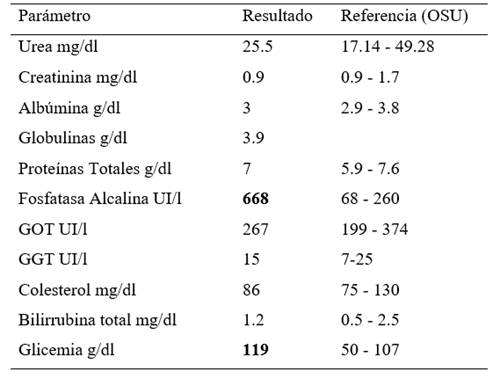
La bioquímica sérica indicó hiperglicemia de 119 mg/dL, el rango de referencia fue de 50-107 mg/dL, según Oregon State University (OSU), y aumento de la fosfatasa alcalina sérica (FAS) 668 UI/L, el rango de referencia fue de 68-260 UI/L.
Tabla 2: Bioquímica sérica del caso clínico
El estudio hormonal reveló una concentración plasmática de ACTH endógena basal de 130 pg/mL (rango de referencia < 50 pg/mL). Los resultados obtenidos del análisis de ACTH basal en los cuatro equinos controles sanos se encontraron dentro de los rangos establecidos por Hart et al. (2021) como normales para la estación del año (primavera).
Tabla 3: Concentración plasmática de ACTH endógena basal del caso clínico reportado y cuatro equinos controle sanos

Discusión
Este es el primer reporte de un caso de PPID en nuestro país. El diagnóstico clínico de PPID se realiza por la presencia de los signos clínicos clásicos de la enfermedad. En este sentido se considera a la hipertricosis como un signo patognomónico de la enfermedad (Innerå et al., 2013; McGowan et al., 2013). La letargia asociada con la PPID podría ocurrir debido al aumento de las concentraciones de β-endorfinas, ya que son un potente agonista opiáceo natural (McFarlane, 2011; 2014; Millington et al., 1988). La pérdida de masa muscular epaxial con atrofia de las fibras musculares de tipo 2A y 2B es común en equinos con PPID (Aleman et al., 2006; Ireland & McGowan, 2018). En un estudio, se observó que las infecciones oportunistas ocurrieron en el 35 % de los equinos afectados, en comparación con solo el 11 % de los equinos gerontes sanos (McFarlane, 2011). Aunque la presentación clínica es clara, las pruebas laboratoriales son necesarias para confirmar el diagnóstico, especialmente cuando los signos clínicos son sutiles o poco precisos (Meyer et al., 2022).
La determinación de ACTH basal es considerada un excelente test diagnóstico de PPID, con una sensibilidad y especificidad por encima de 75 % (Kam et al., 2021). En el caso clínico presentado, se obtuvo una concentración de ACTH de 130 pg/mL, superior al valor reportado por Hart et al. (2021) para equinos sanos (ACTH basal <50 pg/mL). El principal problema de estas pruebas es que existe una clara influencia de la estación anual sobre ellas, lo que hace necesario establecer rangos estacionales para la interpretación de sus resultados. Debido a la falta de antecedentes en nuestro país, realizamos la determinación de la ACTH basal en 4 equinos controles de nuestro país en la misma época del año en la que se realizó el diagnóstico del caso clínico; se utilizaron como referencia las reportadas por Hart et al. (2021) (tabla 3). Según Hart et al. (2021), la ACTH basal como única prueba diagnóstica solo es suficiente si se acompaña de signos clínicos característicos, como en el caso presentado. Por lo tanto, este test no debe ser utilizado como screening o como único diagnóstico en equinos sin signos claros de PPID (Meyer et al., 2022). Considerando que la ACTH basal fluctúa según la estación del año y otros factores como estrés, ejercicio y estado de salud, se desarrolló el test de estimulación con TRH para estandarizar las concentraciones de ACTH y mejorar el diagnóstico, principalmente en cuadros subclínicos (Kam et al, 2021). La desventaja es la falta de disponibilidad de la TRH en muchos países, como ocurre en el nuestro, para la realización de esta prueba de estimulación.
En la hematología se observa leucocitosis con neutrofilia, la cual es de esperarse debido a la sinusitis presente y diagnosticada mediante radiografías (figura 2). También se observa un hematocrito levemente disminuido, el cual es atribuible a una anemia leve o hemodilución. Esto, en conjunto con la leve hiperglicemia observada (119 mg/dL), podría atribuirse a poliuria/polidipsia (PU/PD). Como describe Kirkwood et al. (2022) y como ocurrió en el presente caso, la PU/PD es particularmente difícil de determinar en la especie equina, aunque su prevalencia asciende a un 31 % de los casos de equinos con PPID (Ireland & McGowan, 2018). La causa de la PU/PD no está bien comprendida aún, aunque podría explicarse por una reducción en la secreción de la hormona antidiurética desde la pars nervosa debido a la compresión causada por la hipertrofia de la pars intermedia (Barrell, 2022; Horn et al., 2019; McFarlane et al., 2011), lo que explicaría por qué normalmente estos signos se observan en los casos más graves (Horn et al., 2019). En cuanto al enzimograma hepático, se observa únicamente un aumento de la fosfatasa alcalina sérica, la cual, por ser una enzima inespecífica de daño tisular, su aumento podría deberse tanto al daño en los tejidos por la patología infecciosa (sinusitis) como a la atrofia muscular secundaria a PPID. También la leucocitosis con neutrofilia y el aumento de las FAS podrían ser atribuibles al hipercortisolismo, como sucede en otras especies (Bennaim et al., 2019), sin embargo, en equinos se sabe que el aumento de las concentraciones plasmáticas de ACTH no provoca estimulación adrenal ni hipercortisolemia (Beech et al., 2011; Heinrichs et al., 1990; Morgan et al., 2018; Orth et al., 1982).
Para el tratamiento de la sinusitis se llevó a cabo la trepanación del seno maxilar izquierdo y lavado con suero fisiológico. Antibioticoterapia con gentamicina (6,6 mg/kg) intravenoso cada 24 horas y ceftiofur (2,2 mg/kg) intramuscular cada 24 horas por 9 días. Se realizó desvasado correctivo y tricotomía. El cuadro de sinusitis evolucionó favorablemente luego del tratamiento, con disminución de la inflamación y cicatrización de la trepanación y fístula. Aunque la PPID puede ser controlada con medicación (mesilato de pergolide) de por vida, es una enfermedad crónica e incurable con un pronóstico reservado. Sin embargo, mejores herramientas diagnósticas, disponibilidad de tratamiento farmacológico y cuidados geriátricos adecuados pueden mejorar el pronóstico de esta enfermedad y la calidad de vida de los pacientes (Rohrbach et al., 2012; Spelta & Axon, 2012). El mesilato de pergolide es la terapia de elección, aunque aún no se encuentra disponible en Uruguay, por lo que en el presente caso se realizó tratamiento sintomático.
Conclusiones
Se reporta el primer caso clínico de disfunción de la pars intermedia de la pituitaria (PPID/Cushing) diagnosticado en nuestro país. Al igual que lo descrito en la bibliografía, el caso se presentó en un equino geronte, con signos clínicos característicos y aumento de concentración de ACTH basal que confirman el diagnóstico.
Agradecimientos
A la Dra. Ana Meikle, por la crítica y revisión de este trabajo.
Referencias
Aleman, M., Watson, J. L., Williams, D. C., LeCouteur, R. A., Nieto, J. E., & Shelton, G. D. (2006). Myopathy in horses with pituitary pars intermedia dysfunction (Cushing’s disease). Neuromuscular Disorders, 16, 737-744. https://doi.org/10.1016/j.nmd.2006.07.019
Barrell, E. A. (2022). Polyuria and Polydipsia in Horses. Veterinary Clinics of North America: Equine Practice, 38, 95-108. https://doi.org/10.1016/j.cveq.2021.11.007
Beech, J., Boston, R., & Lindborg, S. (2011). Comparison of cortisol and ACTH responses after administration of thyrotropin releasing hormone in normal horses and those with pituitary pars intermedia dysfunction. Journal of Veterinary Internal Medicine, 25, 1431-1438. https://doi.org/10.1111/j.1939-1676.2011.00810.x
Bennaim, M., Shiel, R. E., & Mooney, C. T. (2019). Diagnosis of spontaneous hyperadrenocorticism in dogs. Part 1: Pathophysiology, aetiology, clinical and clinicopathological features. The Veterinary Journal, 252, 105342. https://doi.org/10.1016/j.tvjl.2019.105342
Bertin, F., & Fraser, N. (2020). Equine Endocrinology. Severn.
Cabrera Blatter, M. F., del Prado, A., Gallelli, M. F., D’Anna, E., Ivanic, J., Esarte, M., Miceli, D. D., Gómez, N. V., & Castillo, V. A. (2012). Blindness in dogs with pituitary dependent hyperadrenocorticism: Relationship with glucose, cortisol and triglyceride concentration and with ophthalmic blood flow. Research in Veterinary Science, 92(3), 387-392. https://doi.org/10.1016/j.rvsc.2011.04.017
Hart, K., Durham, A., Frank, N., McGowan, C., Schott, H., & Stewart, A.J. (2021). Recommendations on diagnosis and management of pituitary pars intermedia dysfunction (PPID). Equine Endocrinology Group. https://idppid.com/sites/default/files/2021%20EEG%20PPID%20Recommendations%20%281%29.pdf
Heinrichs, M., Baumgärtner, W., & Capen, C. C. (1990). Immunocytochemical demonstration of proopiomelanocortin-derived peptides in pituitary adenomas of the pars intermedia in horses. Veterinary Pathology, 27(6), 419-425. https://doi.org/10.1177/030098589902700606
Henneke, D. R., Potter, G. D., Kreider, J. L., & Yeates, B.F. (1983). Relationship between condition score, physical measurements and body fat percentage in mares. Equine Veterinary Journal, 15, 371-372. https://doi.org/10.1111/j.2042-3306.1983.tb01826.x
Horn, R., Bamford, N. J., Afonso, T., Sutherland, M., Buckerfield, J., Tan, R. H. H., Secombe, C. J., Stewart, A. J., & Bertin, F. R. (2019). Factors associated with survival, laminitis and insulin dysregulation in horses diagnosed with equine pituitary pars intermedia dysfunction. Equine Veterinary Journal, 51(4), 440-445. https://doi.org/10.1111/evj.13041
Horn, R., Stewart, A., Jackson, K., Dryburgh, E., Medina-Torres, C., & Bertin, F. (2021). Clinical implications of using adrenocorticotropic hormone diagnostic cutoffs or reference intervals to diagnose pituitary pars intermedia dysfunction in mature horses. Journal of Veterinary Internal Medicine, 35(1), 560-570. https://doi.org/10.1111/jvim.16017
Huang, L., Palmieri, C., & Bertin, F. R. (2022). Correlation of pituitary histomorphometry with dopamine and dopamine D2 receptor expression in horses with pituitary pars intermedia dysfunction. Research in Veterinary Science, 152, 427-433. https://doi.org/10.1016/j.rvsc.2022.08.018
Innerå, M., Petersen, A. D., Desjardins, D. R., Steficek, B. A., Rosser, E. J., Jr., & Schott, H. C., II. (2013). Comparison of hair follicle histology between horses with pituitary pars intermedia dysfunction and excessive hair growth and normal aged horses. Veterinary Dermatology, 24(1), 212–e47. https://doi.org/10.1111/j.1365-3164.2012.01080.x
Ireland, J., & McGowan, C. (2018). Epidemiology of pituitary pars intermedia dysfunction: A systematic literature review of clinical presentation, disease prevalence and risk factors. The Veterinary Journal, 235, 22-33. https://doi.org/10.1016/j.tvjl.2018.03.002
Kam, Y. N., McKenzie, K., Coyle, M., & Bertin, F. R. (2021). Repeatability of a thyrotropin-releasing hormone stimulation test for diagnosis of pituitary pars intermedia dysfunction in mature horses. Journal of Veterinary Internal Medicine, 35(6), 2885-2890. https://doi.org/10.1111/jvim.16281
Keen, J. A., McLaren, M., Chandler, K. J., & McGorum, B. C. (2004). Biochemical indices of vascular function, glucose metabolism and oxidative stress in horses with equine Cushing’s disease. Equine Veterinary Journal, 36(3), 226-229. https://doi.org/10.2746/0425164044877215
Kirkwood, N., Hughes, K., & Stewart, A. (2022). Pituitary pars intermedia dysfunction (PPID) in horses. Veterinary Sciences, 9(10), 556. https://doi.org/10.3390/vetsci9100556
Li, F. I., Spence, R. J., de Laat, M. A., Harris, P. A., Sonntag, J., Menzies-Gow, N. J., Durham, A. E., Bailey, S. R., & Sillence, M. N. (2023). Association between insulin dysregulation and adrenocorticotropic hormone in aged horses and ponies with no clinical signs of pituitary pars intermedia dysfunction. Equine Veterinary Journal, 55(6), 1003-1011. https://doi.org/10.1111/evj.13925
McFarlane, D. (2011). Equine pituitary pars intermedia dysfunction. Veterinary Clinics of North America: Equine Practice, 27, 93-113. https://doi.org/10.1016/j.cveq.2010.12.007
McFarlane, D. (2014). Pathophysiology and clinical features of pituitary pars intermedia dysfunction. Equine Veterinary Education, 26(11), 592-598. https://doi.org/10.1111/eve.12237
McFarlane, D., Dybdal, N., Donaldson, M. T., Miller, L., & Cribb, A. E. (2005). Nitration and increased alpha-synuclein expression associated with dopaminergic neurodegeneration in equine pituitary pars intermedia dysfunction. Journal of Neuroendocrinology, 17(2), 73-80. https://doi.org/10.1111/j.1365-2826.2005.01277.x
McFarlane, D., Hale, G. M., Johnson, E. M., & Maxwell, L. K. (2010). Fecal egg counts after anthelmintic administration to aged horses and horses with pituitary pars intermedia dysfunction. Journal of the American Veterinary Medical Association, 236(3), 330-334. https://doi.org/10.2460/javma.236.3.330
McGowan, T. W., Pinchbeck, G. P., & McGowan, C. M. (2013). Prevalence, risk factors and clinical signs predictive for equine pituitary pars intermedia dysfunction in aged horses. Equine Veterinary Journal, 45(1), 74-79. https://doi.org/10.1111/j.2042-3306.2012.00578.x
Meyer, J. C., Hunyadi, L. M., & Ordóñez-Mena, J. M. (2022). The accuracy of ACTH as a biomarker for pituitary pars intermedia dysfunction in horses: A systematic review and meta-analysis. Equine Veterinary Journal, 54(3), 457-466. https://doi.org/10.1111/evj.13500
Miller, A. B., Loynachan, A. T., Bush, H. M., Hart, K. A., Barker, V. D., Campana-Emard, A. G., Grubbs, S. T., & Adams, A. A. (2021). Effects of pituitary pars intermedia dysfunction and Prascend (pergolide tablets) treatment on endocrine and immune function in horses. Domestic Animal Endocrinology, 74, 106531 https://doi.org/10.1016/j.domaniend.2020.106531
Millington, W. R., Dybdal, N. O., Dawson, R., Jr, Manzini, C., & Mueller, G. P. (1988). Equine Cushing’s disease: differential regulation of beta-endorphin processing in tumors of the intermediate pituitary. Endocrinology, 123(3), 1598-1604. https://doi.org/10.1210/endo-123-3-1598
Morgan, R. A., Keen, J. A., Homer, N., Nixon, M., McKinnon-Garvin, A. M., Moses-Williams, J. A., Davis, S. R., Hadoke, P. W. F., & Walker, B. R. (2018). Dysregulation of cortisol metabolism in equine pituitary pars intermedia dysfunction. Endocrinology, 159(11), 3791-3800. https://doi.org/10.1210/en.2018-00726
Orth, D. N., Holscher, M. A., Wilson, M. G., Nicholson, W. E., Plue, R. E., & Mount, C. D. (1982). Equine Cushing’s disease: plasma immunoreactive proopiolipomelanocortin peptide and cortisol levels basally and in response to diagnostic tests. Endocrinology, 110(4), 1430-1441. https://doi.org/10.1210/endo-110-4-1430
Pease, A. P., Schott, H. C., II, Howey, E. B., & Patterson, J. S. (2011). Computed tomographic findings in the pituitary gland and brain of horses with pituitary pars intermedia dysfunction. Journal of Veterinary Internal Medicine, 25(5), 1144-1151. https://doi.org/10.1111/j.1939-1676.2011.00784.x
Rohrbach, B. W., Stafford, J. R., Clermont, R. S., Reed, S. M., Schott, H. C., II, & Andrews, F. M. (2012). Diagnostic frequency, response to therapy, and long-term prognosis among horses and ponies with pituitary par intermedia dysfunction, 1993-2004. Journal of Veterinary Internal Medicine, 26(4), 1027-1034. https://doi.org/10.1111/j.1939-1676.2012.00932.x
Schott, H. C. (2002). Pituitary pars intermedia dysfunction: equine Cushing’s disease. The Veterinary Clinics of North America: Equine Practice, 18(2), 237-270 https://doi.org/10.1016/s0749-0739(02)00018-4
Spelta, C. W. (2015). Equine pituitary pars intermedia dysfunction: current perspectives on diagnosis and management. Veterinary Medicine, 6, 293-300. https://doi.org/10.2147/VMRR.S74191
Spelta, C.W., & Axon, J.E. (2012) Case series of equine pituitary pars intermedia dysfunction in a tropical climate. Australian Veterinary Journal, 90(11), 451-456 https://doi.org/10.1111/j.1751-0813.2012.00997.x
Tatum, R. C., McGowan, C. M., & Ireland, J. L. (2020). Efficacy of pergolide for the management of equine pituitary pars intermedia dysfunction: A systematic review. Veterinary Journal, 266, 105562. https://doi.org/10.1016/j.tvjl.2020.105562
Nota de contribución
1. Conceptualización, 2. Curación de datos 3. Análisis formal, 4. Adquisición de financiación, 5. Investigación, 6. Metodología, 7. Administración de proyecto, 8. Supervisión, 9. Escritura – borrador original, 10. Escritura – revisión y edición.
Mateo Pardié ha contribuido en 1, 2, 3, 5, 6, 7, 8, 9 y 10. Camila Guidi ha contribuido en 2, 5, 6, 7, 8, 9 y 10, Amaia Frade ha contribuido en 2, 5 y 9. Agustina Nieves han contribuido en 2, 5 y 9. Adrián Carzoli ha contribuido en 2 y 10. Paula Pessina ha contribuido en 1, 4 y 10.
Nota del editor
El editor José Manuel Verdes aprobó este artículo