10.29155/VET.60.222.7
Reporte de caso
Utilización de esponjas de colágeno con gentamicina como prevención de infecciones de pared en laparotomía de línea media en equino: reporte de caso clínico*
Use of collagen sponges with gentamicin as prevention of wall infections in midline laparotomy in horses: Clinical case report
Utilização de esponjas de colágeno com gentamicina como prevenção de infecções de parede em laparotomia de linha média em equino: relato de caso clínico
Bruno Inocente1 0000-0002-3225-1512
María del Carmen Cuns1 0009-0008-8692-4306
Florencia Graglia Giménez1 0000-0002-0439-0654
Dietrich Pizzigatti1 0000-0002-2862-8743
1 Unidad de Clínica y Cirugía en Equinos, Clínicas y Hospital Veterinario, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay. Autor para correspondencia: bruinoc@gmail.com
*Los contenidos de este trabajo son parte de la tesis de grado Uso de transportadores de antimicrobianos en el tratamiento de infecciones en heridas accidentales y quirúrgicas en equinos / Bruno Germán Inocente Clain, de Bruno Inocente, que fue defendida públicamente el 31 de mayo de 2019, como parte de las exigencias para obtener el título de Doctor en Ciencias Veterinarias (DCV) en la Facultad de Veterinaria de la Universidad de la República.
El síndrome abdomen agudo (SAA) equino es una de las patologías con mayor mortalidad y la laparotomía por línea media es una conducta frecuente para su resolución. Además de los riesgos inherentes al procedimiento quirúrgico, las complicaciones asociadas a la línea de incisión deben ser consideradas ya que interfieren directamente con el éxito del procedimiento e incluso la sobrevida del animal. En este contexto, presentamos observaciones en cuanto al uso de una esponja de colágeno (biotransportador) impregnada con antibiótico en el cierre abdominal de una yegua sometida a una laparotomía para la resolución de cólico obstructivo en colon menor. La síntesis de pared abdominal se realizó con patrones estándar de sutura en dos planos: músculo recto abdominal y subcutáneo-piel. Entre las suturas de la pared abdominal y el subcutáneo-piel fueron depositadas esponjas de colágeno impregnadas con sulfato de gentamicina (1,65 mg/kg). El cuidado posoperatorio fue con AINEs, antibiótico sistémico y curaciones estándar (antisepsia tópica). Durante la corta hospitalización, se realizó la observación diaria de la herida quirúrgica y el seguimiento clínico, la evolución fue muy positiva con respecto a otros procedimientos previos, sin el aditivo del biotransportador. La cicatrización de la piel evolucionó con mínima formación de edema y exudado, la unión de los bordes de incisión se mantuvo desde el período hospitalario hasta el retiro de los puntos (14.o día) y recibió el alta el día siguiente. De acuerdo a estos resultados, y comparándolos con los antecedentes de complicaciones en heridas quirúrgicas vivenciados, creemos que el uso de esponjas de colágeno impregnadas con antibióticos puede considerarse una alternativa viable y aplicable en la prevención de infecciones incisionales.
Palabras clave: Laparotomía, Infección de sitio quirúrgico, Esponja de colágeno, Gentamicina, Biotransportador.
Abstract
Equine Acute Abdomen Syndrome (AAS) is one of the pathologies with the highest mortality, with midline laparotomy being a frequent procedure for its resolution. In addition to the risks inherent to the surgical procedure, complications associated with the incision line must be considered since they directly interfere with the success of the procedure and even the survival of the animal. In this context, we present observations regarding the use of a collagen sponge (biocarrier) impregnated with antibiotic in the abdominal closure of a mare undergoing a laparotomy for the resolution of obstructive colic in the minor colon. Abdominal wall synthesis was performed with standard suture patterns in two planes: rectus abdominis muscle and subcutaneous-skin. Collagen sponges impregnated with gentamicin sulfate (1.65 mg/kg) were placed between the abdominal wall and subcutaneous-skin sutures. Postoperative care was with NSAIDs and systemic antibiotics and standard dressings (topical antisepsis). During the short hospitalization, daily observation of the surgical wound and clinical follow-up were carried out with a very positive evolution compared to other previous procedures, without the addition of the bio transporter. Skin healing evolved with minimal formation of edema and exudate, maintaining the union of the incision edges during the hospital period, until the removal of the skin stitches (14th day), and discharge the following day. According to these results, and comparing it to the history of complications in surgical wounds experienced, we believe that the use of collagen sponges impregnated with antibiotics can be considered a viable and applicable alternative in the prevention of incisional infections.
Keywords: Laparotomy, Surgical site infection, Collagen sponge, Gentamicin, Biocarrier.
Resumo
A Síndrome do Abdome Agudo Equino (SAA) é uma das patologias com maior mortalidade, sendo a laparotomia mediana um procedimento frequente para sua resolução. Além dos riscos inerentes ao procedimento cirúrgico, as complicações associadas à linha de incisão devem ser consideradas, pois interferem diretamente no sucesso do procedimento e até na sobrevivência do animal. Nesse contexto, apresentamos observações quanto ao uso de esponja de colágeno (biocarreador) impregnada com antibiótico no fechamento abdominal de égua submetida a laparotomia para resolução de cólica obstrutiva em cólon menor. A síntese da parede abdominal foi realizada com padrões de sutura padrão em dois planos: músculo reto abdominal e pele subcutânea. Esponjas de colágeno impregnadas com sulfato de gentamicina (1,65 mg/kg) foram colocadas entre a parede abdominal e as suturas da pele subcutânea. Os cuidados pós-operatórios foram com AINEs e antibióticos sistêmicos e curativos padrão (antissepsia tópica). Durante o curto internamento foi realizada observação diária da ferida operatória e acompanhamento clínico com evolução muito positiva comparativamente a outros procedimentos anteriores, sem adição do biotransportador. A cicatrização da pele evoluiu com mínima formação de edema e exsudato, mantendo a união das bordas da incisão durante o período hospitalar, até a retirada dos pontos cutâneos (14.º dia), e alta no dia seguinte. De acordo com esses resultados, e comparando-os com o histórico de complicações em feridas cirúrgicas vivenciadas, acreditamos que o uso de esponjas de colágeno impregnadas com antibióticos pode ser considerada uma alternativa viável e aplicável na prevenção de infecções incisionais.
Palavras-chave: Laparotomia, infecção de sítio cirúrgico, Esponja de colágeno, Gentamicina, Biotransportador.
Fecha de recibido: 26/04/2023
Fecha de aceptado: 19/08/2024
Introducción
El síndrome abdomen agudo (SAA) equino se refiere a una patología frecuentemente multifactorial y etiológica que se presenta por posibles condiciones causantes de dolor abdominal y tiene, hasta la actualidad, un elevado porcentaje de morbilidad y mortalidad en la especie (Brow, 2012; Nardi et. al, 2022). En general, estos cuadros pueden ser corregidos de forma médica, pero existen casos en que la laparotomía exploratoria es necesaria, lo que trae riesgos directos o indirectos al factor inductor del cuadro (Bischofberger et al., 2010; Dukti y White, 2009; Pagliosa y Alves, 2004).
A pesar de las investigaciones en curso y los avances en la técnica quirúrgica durante la última década, las tasas citadas de complicaciones de la incisión todavía oscilan entre el 7 y el 37 % (Rubio-Martínez et al., 2012; Tnibar et al., 2013). Freeman et al. (2012), al evaluar 113 registros de caballos sometidos a laparotomía de línea media (LLM) en EE. UU., reportaron que un 43 % de ellos fueron diagnosticados con infección posoperatoria y, de estos, 23 tenían infección incisional. Mair y Smith (2005), en un estudio retrospectivo de 300 casos de posoperatorios de cólico (1994-2001), reportaron que de los 73 casos (29 % de 252 animales) sometidos a laparotomía 14 % tuvieron algún grado de infección y 86 %, drenaje incisional. Rubio-Martínez et al. (2012) reportaron un 12,5 % (188/1506) de casos de infección incisional posquirúrgica de cólicos en equinos desde 1994 hasta 2008. En este contexto, el ambiente cutáneo de las heridas traumáticas o quirúrgicas en los equinos, normalmente, se complica, pues albergan una gran comunidad polimicrobiana (Freeman et al., 2002; Westgate et al., 2011). Dichas complicaciones aumentan los tiempos de hospitalización (7-21 días), conllevan tiempos de recuperación más largos (10-26 días en infecciones múltiples) y mayores costos asociados, sin olvidarse del riesgo de vida del animal (Bischofberger et al., 2010; Brow, 2012; Freeman et al., 2012; French et al., 2002; Pagliosa y Alves, 2004; Scharner et al., 2018). Por eso, en la laparotomía, el cierre abdominal es uno de los momentos más importantes del acto quirúrgico y las complicaciones incisionales (comunes en más del 40 % de los caballos) tienen un rol desalentador en el alta del paciente posquirúrgico (Freeman, et al., 2002; Pagliosa y Alves, 2004; Rijkenhuizen, 2011; Salciccia et al., 2020).
Los factores que contribuyen para el surgimiento de complicaciones incisionales en equinos están asociados con el paciente, la lesión, el procedimiento quirúrgico, la anestesia y su recuperación (Brow, 2012; Colbath et al., 2014; Darnaud et al., 2016; Freeman et al., 2002; Pagliosa y Alves, 2004; Salciccia et al., 2020). La extensión de incisión (≥27 cm), el uso de hilos no absorbibles, el patrón de sutura doble o aislada y el cierre en dos capas, los tiempos de cirugía >2 horas, el mantenimiento de PaO2 <80mm Hg transoperatoria, el aumento de presión intraabdominal y la dificultad en la recuperación anestésica también pueden influir en la cicatrización de la incisión de la línea alba y en las mayores tasas de ISQ (Bischofberger et al., 2010; Salciccia et al., 2020; Shearer et al., 2020).
Las heridas quirúrgicas de LLM, consideradas heridas limpias o limpias-contaminadas, presentan diferentes probabilidades de desarrollar ISQ, esta última tiene un riesgo 24 veces mayor que la primera (Adam y Southwood, 2006; Brow, 2012; Rijkenhuizen, 2011). Dentro de las señales de complicación están el edema, el drenaje o la secreción de exudado focal, el ISQ, la dehiscencia de la sutura, la formación de abscesos extraperitoneales y la peritonitis (Bischofberger et al., 2010; Freeman et al., 2002; Pagliosa y Alves, 2004; Rijkenhuizen, 2011; Rubio-Martínez, et al., 2012). Además, la infección incisional en LLM en equinos es el factor de riesgo más importante (7-43 %) y el principal responsable de la formación de hernias incisionales, la probabilidad 17-62 veces es mayor que en caballos sanos (Dukti y White, 2009; Shearer et al, 2020). Dichos cuadros son acompañados con frecuencia por drenaje focal seroso o serosanguinolento, con o sin presencia de filamentos de fibrina, y edema en el drenaje no infeccioso, pero cuando se encuentra ante un cuadro infeccioso, es asociado al drenaje de material mucopurulento, dolor y aumento de temperatura local; se puede presentar pirexia (≥ 38,3 °C) o no (Freeman et al., 2002, 2012; Mair y Smith, 2005; Rijkenhuizen, 2011.).
Las herramientas preventivas comúnmente empleadas en el control infeccioso en la rutina quirúrgica son la asepsia local (yodopovidona o clorhexidina) y el tratamiento convencional profiláctico con antimicrobiano sistémico (AMS), es más común la combinación de un betalactámico (penicilina) con un aminoglicósido (gentamicina), en dosis variadas (Bischofberger et al., 2010; Dória et al., 2020; Freeman et al., 2012; Salciccia et al., 2020; Stefanou et al., 2020). Asimismo, la inflamación, formación de pannus, el acumulo de restos necróticos y la acidosis generada en el ISQ reducen la perfusión y actividad de estos agentes AMS en el sitio quirúrgico (Adam y Southwood, 2006; Brow, 2012). Para prevenir infecciones y mejorar la eficacia de la terapia antibiótica surgen nuevas técnicas, como la aplicación profiláctica o terapéutica de implantes transportadores antimicrobianos (biodegradables o no) en forma local (Cruz et al., 2006; Ruszczak y Friess, 2003; Wachol-Drewek et al., 1996. Estos transportadores antimicrobianos están disponibles en la actualidad comercialmente (Europa y Norteamérica) y presentan resultados clínicos reportados en humanos, bovinos, caninos y traumas ortopédicos en equinos (Chia et al., 2014; Cruz et al., 2006; Delfosse et al., 2011; Popescu et al., 2013). En resumen, su finalidad es liberar, de forma lenta y por largo plazo, elevadas concentraciones del antimicrobiano en el sitio de implante. Además, se evita la posibilidad de generar toxicidad mediante el uso de antibióticos sistémicos (Delfosse et al., 2011; Popescu et al., 2013; Ruszczak y Friess, 2003). Estos implantes quirúrgicos comenzaron a ser utilizados en la década del setenta, su base principal es el colágeno (años ochenta), más eficaz por su biocompatibilidad y absorción (Chia et al., 2014; Cruz et al., 2006; Popescu et al., 2013; Wachol-Drewek et al., 1996). El uso de las esponjas de colágeno impregnadas con antibiótico (principalmente aminoglucósidos) fue un descubrimiento importante para el control de las infecciones en cirugía ortopédica y traumática (Chia et al., 2014; Cruz et al., 2006; Delfosse et al., 2011; Ruszczak y Friess, 2003; Wachol-Drewek et al., 1996).
El objetivo de este trabajo fue reportar datos observacionales y resultados clínicos del uso de la esponja de colágeno impregnada con gentamicina en la síntesis de la pared abdominal de una herida quirúrgica en un equino hembra sometida a laparotomía de línea media en el Hospital Veterinario de la Facultad de Veterinaria, Universidad de la República.
Caso clínico
Fue admitido en la unidad Clínica y Cirugía en Equinos del Hospital Veterinario de la Facultad de Veterinaria, Udelar, un equino hembra, raza criolla, de 5 años de edad, de 420 kg de peso vivo, utilizada para tareas de recolección de residuos. En el relato del historial del cuadro clínico, el tutor reportó que encontró al animal agitado, intentando revolcarse y con distensión en ambos flancos. El tutor sumó datos de manejo general y relató que el equino tenía acceso a restos de basura de un terreno sucio. No fueron aportados datos de anamnesis relevantes, solo que el cuadro clínico tenía una evolución de >24 horas y que el animal estaba deprimido, no se alimentaba, se miraba ambos flancos con frecuencia, se pateaba el abdomen, presentaba anuria y había defecado por última vez hacía 24 horas.
En el examen objetivo general, presentó normotermia (37,4 °C), taquicardia leve (65 lpm), taquipnea (40 mpm), tiempo de llenado capilar normal (2 segundos), mucosas pálidas y prueba de pliegue cutáneo >3 segundos. En el examen particular del aparato digestivo, se observó timpanismo en ambos flancos y reducción de ruidos en cuadrante abdominal superior derecho. En el examen por tacto rectal fue posible identificar el ciego levemente distendido por presencia de gas, todas las vísceras en su posición anatómica normal y un elemento material de consistencia firme y palpable en colon menor que generaba obstrucción del tránsito aboral del asa intestinal. A partir de los datos de la anamnesis y el resultado del examen clínico (tacto rectal) se planteó un diagnóstico presuntivo de SAA obstructivo, lo que indicó realizar el procedimiento quirúrgico de laparotomía exploratoria por línea media.
Prequirúrgico, el animal recibió dipirona[1] (25 mg/kg) y fluidoterapia de reposición (16 L) con solución de Hartmann, ambos por vía intravenosa. La inducción y anestesia general inhalatoria fue llevada a cabo mediante protocolos de rutina del hospital, la preanestesia fue con clorhidrato de xilacina[2] (1,1 mg/kg), inducido con etergliceril guayacolato[3] al 5 % en infusión continua y un bolo de clorhidrato de ketamina[4] (2,2 mg/kg). El mantenimiento anestésico fue hecho con anestesia inhalatoria (isofluorano[5] CAM 3,5-4,5 %) y ventilación mecánica. Después de los procedimientos de posicionamiento (decúbito dorsal), se realizó tricotomía de la región del abdomen ventral y la piel se preparó asépticamente frotando con cepillo quirúrgico impregnado con PVP iodada[6] y agua (tres veces), luego, se procedió al secado con gasa estéril impregnada con alcohol y la disposición de los campos quirúrgicos. La antisepsia de manos y preparación del equipo quirúrgico (cirujano, ayudante e instrumentista) siguió conductas estandarizadas por el hospital: el lavado de manos y antebrazos durante 5 minutos con un cepillo de fregar con gluconato de clorhexidina 4 %[7] seguido de la aplicación de una solución a base de alcohol etílico al 70 %.
Después de la preparación y el plan anestésico, se realizó una incisión magistral preumbilical de piel con bisturí, en región de línea media, comenzando por 5 cm craneal al ombligo y extendiéndose cranealmente por 35 cm. Dicha incisión se profundizó involucrando subcutáneo y línea alba, realizando hemostasia de pequeños vasos sangrantes. La exploración abdominal y resolución quirúrgica siguió la metodología y los procedimientos estandarizados de la literatura tradicional.
El cierre de pared abdominal siguió dos planos de sutura absorbible, se comenzó con suturas simples aisladas de la línea alba, incluyendo subcutáneo con aguja no traumática (USP 25). Paralelo al tiempo de cierre de este primer plano, cinco esponjas de colágeno[8] quedaron impregnadas en 6,9 ml de sulfato de gentamicina[9] (figura 1) hasta su completa absorción (10 minutos) a temperatura ambiente (± 20 °C). El cálculo de la cantidad de esponjas utilizadas fue con base en el tamaño de la incisión y la cantidad de gentamicina a administrar con base en una dosis de 1,65 mg/kg (Chia et al., 2014), el total fue igual a ¼ de la dosis sistémica (6,6 mg/kg). Luego se colocaron las esponjas cubriendo la longitud de la incisión entre los planos de cierre de la línea alba (figura 2). El cierre del segundo plano-piel (figura 3) fue hecho con sutura simple aislada no absorbible (poliamida, UPS 3[10]) y aguja no traumática recta.

Figura 1: Durante el transcurso de la cirugía (cierre del primer plano), se observa la impregnación de las esponjas de colágeno en sulfato de gentamicina en la dosis de 1,65 mg/kg (6,95 ml) por 10 minutos
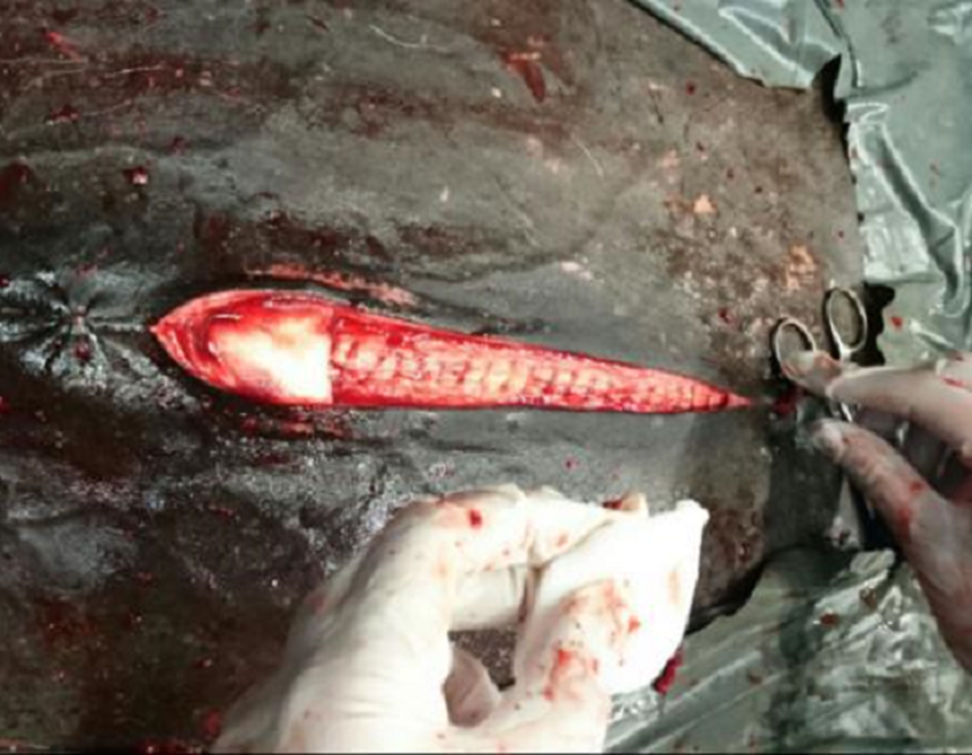
Figura 2: Sutura de pared abdominal (línea alba) en patrón simples aislado con hilo de poliglactina 910 (UPS 2). Obsérvese la implantación de las esponjas de colágeno, ya impregnadas con gentamicina, sobre línea media
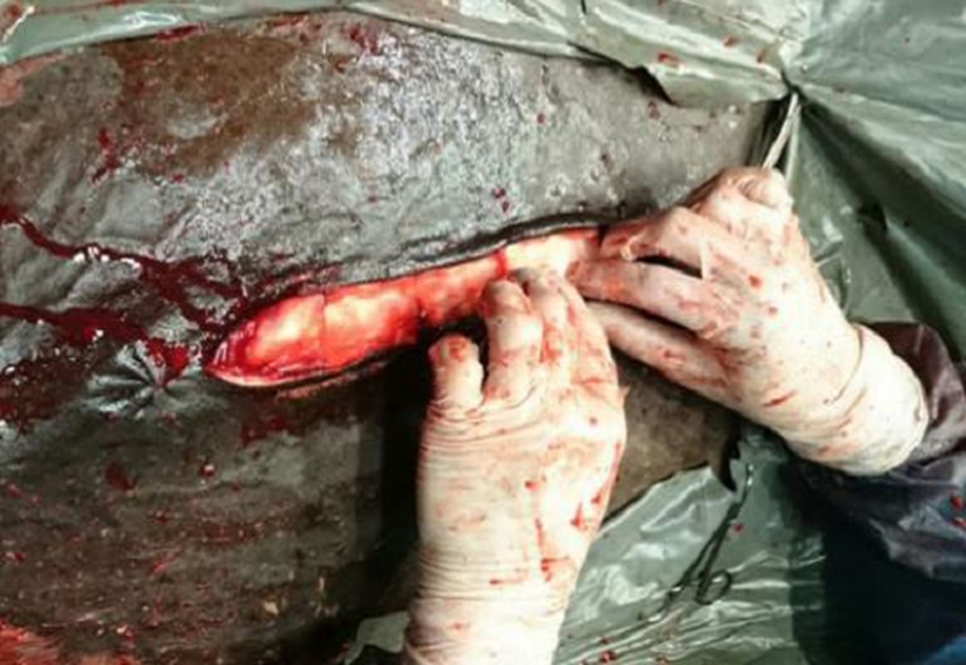
Figura 3: Colocación de las cinco esponjas de colágeno implantadas en línea media ventral entre línea alba (suturas) y la piel, posterior cierre con sutura de piel en patrón simple aislado, con hilo de poliamida (UPS 3)
El procedimiento llevó, desde el derribo anestésico hasta su recuperación, cerca de 150 minutos, sin observar complicaciones. La terapia posoperatoria empezó al día siguiente con la administración de dipirona (25 mg/kg, IV) y penicilina G procainica con estreptomicina[11] (20 000 UI/kg IM, SID, por 10 días). En el segundo día se agregó a la terapia posquirúrgica el flunixin de meglumine[12] (1,1 mg/kg IV, BID, por 7 días), gentamicina (6,6 mg/k IV, SID, por 7 días), duchas frías (BID, 10 días) y curación tópica de la herida con yodopovidona 0,1 %[13] (BID). El tiempo considerado para la evaluación posoperatoria fue desde el momento posoperatorio inmediato (día 0) hasta la fecha de alta médica (días 15), donde se le sacaron los puntos de piel y se constató el cierre completo de la herida.
Durante dicho período el animal fue sometido a evaluación clínica general y objetiva, dos veces por día, mediante parámetros cuantitativos fisiológicos y cualitativos (observación de la herida quirúrgica) en forma simultánea. Los parámetros evaluados sirvieron de indicador del pronóstico posquirúrgico y de la evolución de la herida quirúrgica; la frecuencia respiratoria, la cardíaca y la temperatura corporal fueron los más relevantes. Se consideraron observaciones clínicas cualitativas de la herida quirúrgica, la sensibilidad dolorosa al tacto y la presencia de edema (signo de Godet +1/+4) perincisional, cantidad y aspecto del drenaje (si presenta) y presencia de complicaciones (hernia o dehiscencia incisional), apoyados por la metodología descrita por Gardner et al. (2001).
Observamos que, en el transcurso de su internación (0-14), los parámetros clínicos generales permanecieron estables, con una variabilidad mayor solamente en la frecuencia cardíaca (50 ± 8 lpm), que presentó oscilaciones, en general, dentro de la normalidad. La frecuencia respiratoria fue de 15 ± 4 mpm, la temperatura corpórea de 37,2 ± 0,4 °C y el tiempo de llenado capilar y pliegue cutáneo de 2 ± 1 s, Los ruidos abdominales, así como las funciones fisiológicas (apetito, heces y orina), estuvieron presentes desde el posquirúrgico inmediato hasta el alta. Dichos parámetros fisiológicos nos indicaron que la evolución posoperatoria transcurrió de manera normal lo que permitió hacer hincapié en la variable cualitativa/ subjetiva, que fue la de nuestro principal interés. Estas variables (tabla 1) fueron evaluadas a diario y registradas a través de fotografías en 4 instancias (figuras 4, 5, 6 y 7) dentro de esos 15 días. El día 2 (figura 4) posquirúrgico registramos la primera imagen donde se observó formación de edema perincisional; la herida no presentaba calor local ni supuración purulenta, aunque presentaba un leve dolor a la palpación. El día 5 (figura 5) notamos una evidente disminución del edema, descartamos calor local o supuraciones y no observamos ningún signo de dolor a la palpación. El día 10 (figura 6) casi no observamos edema y la evolución continuó siendo positiva, con una buena evolución de tejido cicatrizal. El día 14 de internación (figura 7) se registró una cicatrización completa, sin presencia de edema ni secreciones de ningún tipo, por lo que el día 15 se procedió a retirar los puntos. Mediante la observación diaria constatamos de forma subjetiva que la herida evolucionó favorablemente en un tiempo aceptable. De esta última variable se puede deducir que la terapia complementaria no fue perjudicial para el proceso de cicatrización.
Tabla 1: Evaluación descriptiva de parámetros cualitativos observacionales de la evolución de la herida quirúrgica
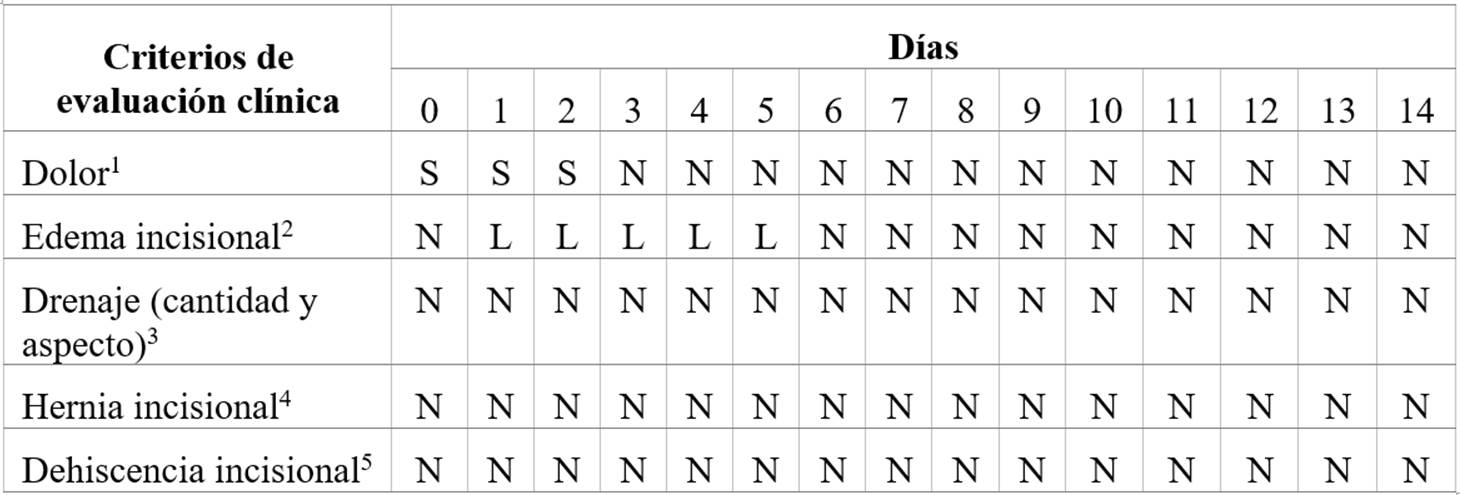
1Dolor al tacto superficial perincisional, S: presente, N: ausente. 2N: ausente, L: leve y godet 1, M: moderado y godet 2, S: severo y godet 3, I: infección y godet 4. 3N: ausente. Cantidad: 1 (leve), 2 (moderada) y 3 (severa). Aspecto: a (hemorrágica), b (seroso), c (seromucoso), d (purulento). 4 S: presente, N: ausente. 5S: presente, N: ausente

Figura 4: Día 2 posquirúrgico, obsérvese formación de edema perincisional, herida sin secreción

Figura 5: Día 5 posquirúrgico, obsérvese una evidente disminución del edema, herida sin secreción

Figura 6: Día 10 posquirúrgico, no se observa presencia de edema, la herida evolucionó favorablemente, se observa un buen aspecto del tejido cicatrizal sin complicaciones
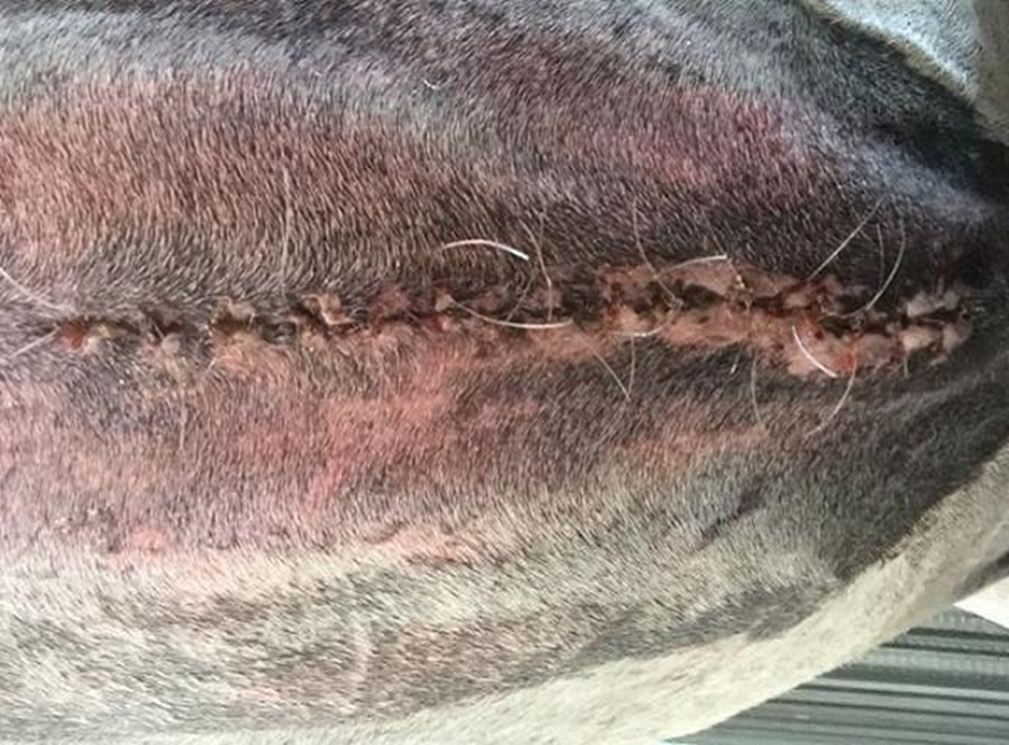
Figura 7: Día 14 posquirúrgico se registró una cicatrización completa, quitándose los puntos de piel al día 15 sin complicaciones
Discusión
Las cirugías de cólico equino siempre son procedimientos de mucha incertidumbre y preocupación para el cirujano. Los protocolos estandarizados de preparación del paciente y el equipo quirúrgico, el cuidado en el momento de incisión abdominal, los principios y técnicas de exploración abdominal, el cierre adecuado de las capas abdominales y el cuidado posoperatorio por sí solo no garantizan el completo éxito del procedimiento. Estos sirven de base para el procedimiento general, es tarea del cirujano conocerlos, así como tener en cuenta las alternativas posibles y realizables acorde a la situación quirúrgica, teniendo como objetivo la mejora del paciente.
La observación de edema perincisional y leve dolor al tacto hasta el quinto día posoperatorio del caso están respaldados por la bibliografía, son considerados eventos inflamatorios normales en el entorno de la herida debido a la reacción infiltrativa del tejido de reparación (Dória et al., 2020). Bischofberger et al. (2010) reportaron incluso sensibilidad dolorosa y edema mantenidos por tiempos posoperatorios superiores (hasta nueve días), sin relación con ISQ. En un ensayo clínico de 188 caballos sometidos a LLM por motivos variados de cólico se observó que el 36 % presentaron edema evidente o excesivo, algunos con drenaje de trasudado (8,5 %), otros con drenaje purulento (11,7 %) y un total de 25 (13,9 %) generaron hernia incisional (Rijkenhuizen, 2011). El edema perincisional exacerbado produce una reducción de la tensión de oxígeno del tejido y de la función inmunitaria local y el retraso en la cicatrización, lo que proporciona un entorno favorable para el crecimiento bacteriano. Así que la presencia de exudado purulento y la combinación de los factores predictores piréticos (primer pico febril > 48 h, temperatura rectal >39, 2 °C y tiempo del pico de temperatura rectal > 48 h) son relacionados con complicaciones infecciosas posquirúrgicas (Freeman et al., 2012).
Comúnmente, en las LLM, se describe el uso de protección incisional con gasas y antiséptico, en las primeras 12 h posoperatorias y cambio de estas cada 24-36 h (Bischofberger et al., 2010; Freeman et al., 2002; Tnibar et al., 2013). El vendaje incisional tiene como objetivo proteger a la contaminación de la herida por decúbito. Incluso, el uso de un vendaje completo del abdomen 12 h postquirúrgica es sugerido para reducir la contaminación de la herida y la formación de edema y de la presión intrabdominal de las vísceras (Freeman et al., 2002; Tnibar et al., 2013). Nuestro criterio fue no utilizar estos vendajes ya que seguimos los lineamientos que los relacionan con el aumento de ISQ, provocan disnea respiratoria por compresión y generan acúmulo de exudado, sobre todo, en días húmedos y calientes (Bischofberger et al., 2010; Pagliosa y Alves, 2004). Rijkenhuizen (2011) describe que el vendaje abdominal previene la formación de edema en 23 % (23/98) de los caballos operados de cólico por LLM, así como la dehiscencia de la herida y de hernias incisionales (12/98). En nuestro caso, debido a la evolución positiva del paciente, que no presentó durante el período de hospitalización signos sugestivos de ISQ, nuestra conducta buscó contribuir al proceso de cicatrización, debido a la mayor oxigenación de esta.
Las bacterias más frecuentemente aisladas en infecciones incisionales son las del género Staphylococcus aureus, incluso la cepa meticilino resistente (Cruz et al., 2006). Estudios científicos que ya se han llevado a cabo confirman la prevalencia de poblaciones bacterianas del género Staphylococcus spp., Escherichia coli spp. y Enterobacter spp. en región de línea media de equinos (Bischofberger et al., 2010). En un total de 340 bacterias aisladas de 41 heridas traumáticas y quirúrgicas en muestras de piel equina, los géneros Pseudomonas aeruginosa (5,6 %), Enterococcus faecium (5,6 %) y Staphylococcus spp (20,5 %) fueron los más identificados (Westgate et al., 2011). A pesar de que en nuestro caso no se realizó hisopado de la herida quirúrgica, creemos que la esponja de colágeno impregnada con gentamicina y la simple antisepsia de rutina en la línea de incisión fueron eficientes para prevenir una infección comensal o nosocomial. En general, la prevención de infección incisional en LLM solo por el uso perioperatorio de AMS (≥60 y ≤120 minutos) no está garantizada (Freeman et al., 2012). Incluso, Bischofberger et al. (2010) no obtuvieron éxito en reducir la ocurrencia de complicaciones incisionales (26/100 caballos) post LLM, aun haciendo reaproximación subcutánea con sutura recubierta por antibacteriano (triclosan). Además, fue mayor la ocurrencia de drenaje incisional (14/26) en el grupo con el uso de dicha sutura.
Las esponjas de colágeno impregnadas con gentamicina —ya disponibles comercialmente[14]— tienen efecto comprobado en gran cantidad de trabajos científicos y de empleo clínico (Chia et al., 2014; Popescu et al., 2013). Sin embargo, en veterinaria existen pocos estudios prácticos publicados en casos de fracturas expuestas, artrodesis infectadas e infecciones de tejidos blandos en equinos, rumiantes y caninos; todos presentaron resultados positivos y sin efectos secundarios (Chia et al., 2014; Cruz et al., 2006; Delfosse et al., 2011). Estudios in vivo en humanos (1500 pacientes) reportan que el uso de la esponja impregnada con gentamicina garantiza concentraciones locales superiores (170-9000 mg/l) a la concentración inhibitoria mínima (16-64 mg/l) de patógenos comúnmente identificados en pacientes posquirúrgicos de origen digestivo, vasculares y en reconstrucción de heridas (Ruszczak y Friess, 2003). Además, creemos en la mayor contribución de la esponja de colágeno debido a su efecto local, llena el espacio muerto subcutáneo, actúa como hemostático e influencia de manera positiva en la cicatrización de la herida (Delfosse et al., 2011).
El uso local del sulfato de gentamicina asociado a un biotransportador (esponja de colágeno) es una alternativa viable visto que el principio posee una baja capacidad de penetración tisular y una gran nefro y ototoxicidad cuando son suministrados por vía sistémica. La esponja, que posee una estructura tridimensional y tres capas de porosidad distintas, hace que su degradación gradual por colagenasas naturales libere de forma gradual y continua la gentamicina, lo que garantiza la concentración elevada local, suficiente para difundirse en biopelículas, y torna esta vía más efectiva frente a las principales bacterias comensales de la piel equina (Delfosse et al., 2011; Ruszczak y Friess, 2003; Westgate et al., 2011). Además, debido a que los aminoglucósidos presentan efectos “dosis dependiente” y “posterapéutico” (Ruszczak y Friess, 2003), comprobados por el período de distribución local del fármaco hasta 3-4 días (Cruz et al., 2006; Delfosse et al., 2011; Ruszczak y Friess, 2003; Wachol-Drewek et al., 1996), la elección de la gentamicina y el uso de la esponja de colágeno demostraron un buen resultado en la prevención de la ISQ.
El uso de terapia sistémica en paralelo a la implantación de la esponja con antimicrobianos pareciera ser de carácter subjetivo y su uso queda a discreción del veterinario a cargo, sabiendo que tanto el uso del AMS con los implantes como el de solamente los implantes puede proveer resultados positivos al tratamiento (Delfosse et al., 2011).
Conclusión
Según los datos bibliográficos, creemos que el uso de transportadores de antimicrobianos en el tratamiento de infecciones de tejidos blandos en equinos es una alternativa viable. Dicha afirmación tiene en consideración las propiedades del colágeno en la herida, sumado a la profilaxis/terapéutica antimicrobiana impregnada en ella, con esto se evita la toxicidad ocasionada por los AMS. En nuestro caso, las esponjas demostraron ser moldeables a la hora de su utilización, lo que nos facilitó su implantación sin generar lesiones posteriores, como irritación o granulación, entre otras, y se acopló a los tejidos de manera pasiva. Así que, a partir de los resultados obtenidos en este caso en particular (y con base en la experiencia del cirujano frente al cuidado de heridas quirúrgicas), el uso de las esponjas de colágeno embebidas en gentamicina fue un complemento útil para la recuperación de la herida quirúrgica de LLM de equinos. Igualmente, más estudios de carácter experimental deben ser realizados, sobre todo, siguiendo la metodología de análisis cuantitativa y estadística sobre el efecto de las esponjas de colágeno y su asociación con antimicrobianos en la reparación cutánea de equinos.
Agradecimientos
Agradecemos a toda la unidad de Clínica y Cirugía en Equinos de la Facultad de Veterinaria, Universidad de la República, por la atención de este paciente en su período de internación. También a los propietarios, por la confianza, y a los doctores Oscar Daniel Sant’Ana Saucedo y Tatiana Osorio Delgado, por la participación en el caso.
Referencias bibliográficas
Adam, E. N., y Southwood, L. L. (2006). Surgical and traumatic wound infections, cellulitisy myositis in horses. Veterinary Clinics of North America: Equine Practice, 22(2), 335-36. doi:10.1016/j.cveq.2006.04.003
Bischofberger, A. S., Brauer, T., Gugelchuk, G., y Klohnen, A. (2010). Difference in incisional complications following exploratory celiotomies using antibacterial-coated suture material for subcutaneous closure: Prospective randomised study in 100 horses. Equine Veterinary Journal, 42(4), 304-309. doi:10.1111/j.2042-3306.2009.00020.x
Brow, J. A. (2012). Ventral midline celiotomy incision infections in the horse. Equine Veterinary Education, 24(3), 116-118. doi:10.1111/j.2042-3292.2011.00290.x
Chia, C. L. K., Shelat, V. G., Low, W., George, S., y Rao, J. (2014). The use of Collatamp G, local gentamicin-collagen sponge, in reducing wound infection. International Surgery, 99(5), 565-570. doi:10.9738/INTSURG-D-13-00171.1
Colbath, A. C., Patipa, L., Berghaus, R. D., y Parks, A. H. (2014). The influence of suture pattern on the incidence of incisional drainage following exploratory laparotomy. Equine Veterinary Journal, 46(2), 156-160. doi:10.1111/evj.12091
Cruz, A. M., Rubio-Martinez, L., y Dowling, T. (2006). New antimicrobials, systemic distributiony local methods of antimicrobial delivery in horses. Veterinary Clinics of North America: Equine Practice, 22(2), 297-322. doi:10.1016/j.cveq.2006.03.006
Darnaud, S. J. M., Southwood, L. L., Aceto, H. W., Stefanovski, D., Tomassone, L., y Zarucco, L. (2016). Are horse age and incision length associated with surgical site infection following equine colic surgery? Veterinary Journal, 217, 3-7. doi: 10.1016/j.tvjl.2016.09.004
Delfosse, V., El Warrak, A., Clerfond, P., y Lussier, B. (2011). Clinical investigation of local implantation of gentamicin-impregnated collagen sponges in dogs. Canadian Veterinary Journal, 52(6), 627-630.
Dória, R. G. S., Freitas, S. H., Laskoski, L. M., Arruda, L. P., y Shimano, A. C. (2020). Correlation between peritonitis and incisional infections in horses. Journal of Equine Veterinary Science, 87, 102903. doi:10.1016/j.jevs.2019.102903
Dukti, S., y White, N. (2009). Surgical complications of colic surgery. Veterinary Clinics of North America. Equine Practice, 24, 515-534. doi:10.1016/j.cveq.2008.09.002
Freeman, D. E., Rötting, A. K. R., y Inoue, O. J. (2002). Abdominal closure and complications. Clinical Techniques in Equine Practice, 1(3), 174-187. doi:10.1053/ctep.2002.35575
Freeman, K. D., Southwood, L. L., Lane, J., Lindborg, S., y Aceto, H. W. (2012). Post operative infection, pyrexia and perioperative antimicrobial drug use in surgical colic patients. Equine Veterinary Journal, 44(4), 476-481. doi:10.1111/j.2042-3306.2011.00515.x
French, N. P., Smith, J., Edwards, G. B., y Proudman, C. J. (2002). Equine surgical colic: risk factors for postoperative complications. Equine Veterinary Journal, 34(5), 444-449. doi:10.2746/042516402776117791
Gardner, S. E., Frantz, R. A., y Doebbeling, B. N. (2001). The validity of the clinical signs and symptoms used to identify localized chronic wound infection. Wound Repair Regen, 9(3), 178-186. doi: 10.1046/j.1524-475x.2001.00178.x
Mair, T. S., y Smith, L. J. (2005). Survival and complication rates in 300 horses undergoing surgical treatment of colic. Part 2: Short-term complications. Equine Veterinary Journal, 37(4), 303-309.
Nardi, K. B., Barros, A. M. C., Zoppa, A. L. V., Silva, L. C. L. C., Ambrósio, A. M., Hagen, S. C. F., . . . Corrêa, R. R. (2022). Large bowel obstruction by enteroliths and/or foreign bodies in domestic equids: retrospective study of cases seen from January 2003 to March 2020. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 74(1), 83-92. doi:10.1590/1678-4162-12442
Pagliosa, G. M., y Alves, G. E. S. (2004). Fatores predisponentes das complicações incisionais de laparotomias medianas em eqüinos. Ciência Rural, 34(5), 1655-1659.
Popescu, F., Rochon, M., y Raja, S. (2013). Impact of Gentamicin - Collagen Sponge (Collatamp) on the incidence of sternal wound infection in high risk cardiac surgery patients. Journal of Cardiothoracic Surgery, 8(Suppl 1), O123. doi:10.1186/1749-8090-8-S1-O123
Rijkenhuizen, A. B. M. (2011). Abdominal bandage after colic surgery – sense or nonsense? Pferdeheilkunde, 27(6), 636-641.
Rubio Martínez, L. M., Cribb, N. C., y Koenig, J. B. (2012). Extraperitoneal incisional abscess formation after colic surgery in 3 horses. Equine Veterinary Education, 24(3), 109-115. doi:10.1111/j.2042-3292.2011.00262.x
Ruszczak, Z., y Friess, W. (2003). Collagen as a carrier for on-site delivery of antibacterial drugs. Advanced Drug Delivery Reviews, 55(12), 1679-1698. doi: 10.1016/j.addr.2003.08.007
Salciccia, A., de la Rebière de Pouyade, G., Gougnard, A., Detilleux, J., Caudron, I., Verwilghen, D., y Grulke, S. (2020). Complications associated with closure of the linea alba using a combination of interrupted vertical mattress and simple interrupted sutures in equine laparotomies. Veterinary Record, 187(11), e94. doi:10.1136/vr.105855
Scharner, D., Gittel, C., Winter, K., Blaue, D., Schedlbauer, C., Vervuert, I., y Brehm, W. (2018). Comparison of incisional complications between skin closures using a simple continuous or intradermal pattern: a pilot study in horses undergoing ventral median celiotomy. PeerJ, 6, e5772. doi:10.7717/peerj.5772
Shearer, T. R., Holcombe, S. J., y Valberg, S. J. (2020). Incisional infections associated with ventralmidline celiotomy in horses. Journal of Veterinary Emergency and Critical Care, 30(2), 136-148. doi:10.1111/vec.12936
Stefanou, A., Worden, A., Kandagatla, P., Reickert, C., y Rubinfeld, I. (2020). Surgical wound misclassification to clean from clean-contaminated in common abdominal operations. Journal of Surgical Research, 246, 131-138. doi:10.1016/j.jss.2019.09.001
Tnibar, A., Grubbe Lin, K., Thurøe Nielsen, K., Christophersen, M. T., Lindegaard, C., Martinussen, T., y Ekstrøm, C. T. (2013). Effect of a stent bandage on the likelihood of incisional infection following exploratory coeliotomy for colic in horses: A comparative retrospective study. Equine Veterinary Journal, 45, 564-569. doi:10.1111/evj.12026
Wachol-Drewek, Z., Pfeiffer, M., y Scholl, E. (1996). Comparative investigation of drug delivery of collagen implants saturated in antibiotic solutions and a sponge containing gentamicin. Biomaterials, 17(17), 1733-1738. doi:10.1016/0142-9612(96)87654-x
Westgate, S. J., Percival, S. L., Knottenbelt, D. C., Clegg, P. D., y Cochrane, C. A. (2011). Microbiology of equine wounds and evidence of bacterial biofilms. Veterinary Microbiology, 150(1-2), 152. doi:10.1016/j.vetmic.2011.01.003
Nota de contribución
Bruno Inocente ha
contribuido en: Conceptualización, Curación de datos, Análisis formal,
Investigación y Escritura-borrador original.
María del Carmen Cuns ha contribuido en: Conceptualización, Metodología y
Administración de proyecto.
Dietrich Pizzigatti ha contribuido en: Análisis formal, Adquisición de
financiación y Escritura-revisión y edición.
Florencia Graglia Giménez ha contribuido en: Administración de proyecto y
Escritura-revisión y edición.
Nota del editor
La editora Cecilia Cajarville aprobó este artículo.