10.29155/VET.60.222.1
Artículo original
Desórdenes hemostáticos en perros (Canis lupus familiaris) con insuficiencia renal crónica
Hemostatic disorders in dogs (Canis lupus familiaris) with chronic renal failure
Distúrbios hemostáticos em cães (Canis lupus familiaris) com insuficiência renal crônica
César Daniel Hernández Pereira1 0000-0002-4526-9228
Fernando Fumagalli1 0000-0001-9127-3546
Claudia Della Cella2 0000-0002-2387-2595
Paula Pessina3 0000-0002-7809-9026
1Unidad de Semiología, Departamento de Clínicas y Hospital Veterinario, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay. Autor para correspondencia: dan30vet@gmail.com
2Unidad de Clínica de Pequeños Animales, Departamento de Clínicas y Hospital Veterinario, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay.
3Unidad de Imagenología, Laboratorios de Análisis Clínicos y de Endocrinología y Metabolismo Animal, Departamento de Clínicas y Hospital Veterinario, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay.
La insuficiencia renal crónica es una patología frecuente en caninos y una importante causa de muerte en esta especie. La finalidad de este estudio fue determinar si la insuficiencia renal crónica (IRC) afecta los parámetros hemostáticos y las variables hematimétricas, así como evaluar si las alteraciones de estos parámetros se correlacionan positiva o negativamente con los niveles séricos de urea y creatinina. Para esto se seleccionaron 9 perros sanos (grupo control) y 14 perros con IRC confirmada, en distintos estadios de evolución acorde a la clasificación de la International Renal Interest Society (IRIS). Se extrajo sangre para la evaluación de crasis sanguínea, hemograma y perfil renal; los resultados obtenidos se compararon entre ambos grupos y entre los distintos estadios evolutivos de IRC. Perros con IRC presentaron hemoglobina, hemoglobina corpuscular media y concentración de hemoglobina corpuscular media menores que en los animales sanos (p = 0,022, p = 0,0001 y p = 0,0001, respectivamente), así como una correlación negativa importante entre los niveles de creatinina y las variables de eritrocitos, hemoglobina y hematocrito. Animales con IRC presentaron niveles más bajos de tiempo de protrombina (TP), p = 0,04, y mayores concentraciones de fibrinógeno con respecto al grupo control. Se observó una correlación positiva entre el aumento del tiempo de sangrado en mucosa bucal (TSM) y el aumento de las concentraciones séricas de creatinina y urea. Si bien el TSM no difirió entre el grupo sanos y el grupo con IRC, sí fue mayor en los estadios avanzados de esta patología, lo que está altamente correlacionado con las concentraciones de creatinina y urea séricas. Las alteraciones más notorias de los parámetros de la crasis sanguínea, como era esperable, se observaron en pacientes en estadios 3 y 4 de la IRC, consistente con los signos clínicos observados.
Palabras clave: Sangrado, Anemia, Hemorragias, Trombopatías.
Abstract
Chronic renal failure is a frequent pathology in canines, being an important cause of death in this species. The purpose of this study was to determine whether chronic renal failure (CRF) affects hemostatic parameters and blood count variables, as well as to assess whether alterations in these parameters are positively or negatively correlated with serum urea and creatinine levels. For this, 9 healthy dogs (control group) and 14 dogs with confirmed CRF were selected, in different stages of evolution according to the International Renal Interest Society (IRIS) classification. Blood was extracted for the evaluation of blood crasis, complete blood count and renal profile; the results obtained were compared between both groups and between the different evolutionary stages of CKD. Dogs with CRF presented lower Hemoglobin, mean corpuscular Hemoglobin, and mean corpuscular Hemoglobin concentration than in healthy animals (p = 0.022, p = 0.0001 and p = 0.0001, respectively), as well as a significant negative correlation between levels of creatinine and the variables of erythrocytes, hemoglobin and hematocrit. Animals with CRF presented lower prothrombin time (PT) levels, p = 0.04, and higher fibrinogen concentrations compared to the control group. A positive correlation was observed between increased buccal mucosal bleeding time (BMBT) and increased serum creatinine and urea concentrations. Although the BMBT did not differ between the healthy group and the group with CKD, it was higher in the advanced stages of this pathology, being highly correlated with serum creatinine and urea concentrations. The most notorious alterations in blood crasis parameters, as expected, were observed in patients in stages 3 and 4 of CKD, consistent with the clinical signs observed.
Keywords: Bleeding, Anemia, Hemorrhages, Thrombopathies.
Resumo
A insuficiência renal crônica é uma patologia frequente em caninos, sendo uma importante causa de morte nesta espécie. O objetivo deste estudo foi verificar se a insuficiência renal crônica (IRC) afeta os parâmetros hemostáticos e as variáveis do hemograma, bem como avaliar se as alterações desses parâmetros se correlacionam positiva ou negativamente com os níveis séricos de ureia e creatinina. Para isso, foram selecionados 9 cães saudáveis (grupo controle) e 14 cães com IRC confirmada, em diferentes estágios de evolução de acordo com a classificação da International Renal Interest Society (IRIS). O sangue foi extraído para avaliação da crase sanguínea, hemograma completo e perfil renal; os resultados obtidos foram comparados entre os dois grupos e entre os diferentes estágios evolutivos da DRC. Cães com IRC apresentaram menor concentração de Hemoglobina, Hemoglobina corpuscular média e Hemoglobina corpuscular média do que em animais saudáveis (p = 0,022, p = 0,0001 e p = 0,0001, respectivamente), bem como uma correlação negativa significativa entre os níveis de creatinina e o variáveis de eritrócitos, hemoglobina e hematócrito. Animais com IRC apresentaram menor tempo de protrombina (PT), p = 0,04, e maiores concentrações de fibrinogênio em relação ao grupo controle. Observou-se correlação positiva entre o aumento do tempo de sangramento da mucosa bucal (TSM) e o aumento das concentrações séricas de creatinina e uréia. Embora a TSM não tenha diferido entre o grupo saudável e o grupo com DRC, ela foi maior nos estágios avançados dessa patologia, estando altamente correlacionada com as concentrações séricas de creatinina e uréia. As alterações mais notórias nos parâmetros de crase sanguínea, como esperado, foram observadas em pacientes nos estágios 3 e 4 da DRC, condizentes com os sinais clínicos observados.
Palavras-chave: Sangramento, Anemia, Hemorragias, Trombopatias.
Fecha de recibido: 17/01/2023
Fecha de aceptado: 17/08/2023
Introducción
La enfermedad renal crónica (ERC) es la patología renal más frecuente en el perro y su prevalencia global puede oscilar entre 0,5-1,5 %, lo que representa, aproximadamente, el 5 % del total de muertes en caninos (Brown, 2007; Burkholder, 2000). Se define a la ERC como la disminución de la funcionalidad renal, expresada como un descenso de la tasa de filtración glomerular (TFG) de más del 50 % que persiste durante más de 2-3 meses o bien cuando haya una lesión renal durante el mismo período sin descenso de la TFG (Bartges, 2012; Bartges & Polzin, 2011; Cortadellas, 2010; Polzin, 2011). Una vez realizado el diagnóstico de ERC, la International Renal Interest Society (IRIS) realiza la estadificación de esta, basada en la concentración de creatinina sérica o de SDMA (dimetilarginina simétrica) en la sangre de pacientes en ayunas. Estas variables deberán ser evaluadas en al menos dos ocasiones en un paciente hidratado y estable; esta estadificación permite mejorar el tratamiento y seguimiento adecuado del paciente (IRIS, 2019a; IRIS, 2019b).
Durante la evolución de la ERC se van comprometiendo las funciones renales de manera progresiva, cuanto mayor es el compromiso funcional más evidentes se harán las manifestaciones clínicas en el paciente (anorexia, poliuria-polidipsia, pérdida de peso, vómitos y depresión del sensorio, entre otros), hasta que se instala el síndrome urémico (Polzin, 2011). Este es un síndrome tóxico y polisistémico que se caracteriza por afectar diferentes sistemas del organismo (gastrointestinal, nervioso, cardiorrespiratorio y endócrino) y por alterar el equilibrio ácido-base, el metabolismo calcio/fósforo, el equilibrio electrolítico (sodio-potasio), el sistema hematológico y hemostático, así como el compromiso nutricional del paciente (Polzin, 2011; Bartges, 2012).
Existen numerosos estudios de los efectos de la insuficiencia renal crónica sobre las funciones de la sangre. La presencia de anemia es una afección común en perros y gatos y se ha reportado una correlación negativa entre el aumento de la concentración de la creatinina y la disminución del hematocrito (Kogika et al., 2015). La presencia de la anemia detectada tanto en humanos como en caninos acompaña la ERC como una complicación frecuente de la uremia y, en general, suele ser bien tolerada hasta fases avanzadas de la insuficiencia renal (Hermosín Alcalde et al., 2017). En lo referente a las células de la línea blanca, la información es contradictoria, ya que se han observado casos en los que aumenta el conteo de algunos grupos de estas (Agarwal & Light, 2011), así como otros en los que disminuye (Kim & Kim, 2014; Arai et al., 2018).
Según lo evaluado, la información existente hasta el momento en caninos respecto a los efectos de la IRC sobre la hemostasia es comparativamente menor a los reportes en humanos. Los pacientes con uremia presentan alteraciones hemostáticas que se traducen en episodios de sangrado evidenciados por síntomas hemorrágicos leves y tiempo de sangrado prolongado (Fischer, 2007). Son varios los factores extrínsecos responsables de producir hemorragias, entre ellos la anemia que limita los mecanismos de formación del trombo o la acumulación de toxinas urémicas que tienen un efecto negativo sobre el funcionamiento plaquetario. En este mismo sentido el aumento de la producción vascular de prostaciclina (prostaglandina) y óxido nítrico —potentes inhibidores de la agregación plaquetaria—, la disminución del factor Von Willebrand y el hiperparatiroidismo secundario también contribuye a la aparición de hemorragias (Casserly & Dember, 2003; Sohal et al., 2006; Takahira, 2015).
Si bien históricamente se ha asociado a la ERC con cierta tendencia de esos pacientes a presentar hemorragias, también son comunes los eventos trombóticos en etapa terminal en pacientes con enfermedad renal (Casserly & Dember, 2003). A medida que progresa la enfermedad renal y baja la funcionalidad se observa un aumento de la hipercoagulabilidad, como consecuencia de la inflamación sistémica presente y el daño difuso a nivel endotelial (Fischer, 2007; Naumnik et al., 2002; Pawlak et al., 2003). La hipercoagulabilidad se ve propiciada por la lesión de las células endoteliales, lo que lleva a una activación secundaria de la cascada de coagulación y pérdida a través de la orina de factores pro-fibrinolíticos y proteínas anticoagulantes. Como consecuencia de esto, a pesar de la hipercoagulabilidad presente, es común observar un aumento del tiempo de sangrado de mucosas en perros con uremia (Citak et al., 2000; Donahue et al., 2011; Green, 1988). Por tanto, el patrón hemostático en la enfermedad renal crónica es complejo, ya que paradójicamente en estos pacientes coexiste una tendencia al sangrado con un mayor riesgo de fenómenos trombóticos y ambas complicaciones se pueden presentar en un mismo individuo (Casonato et al., 2001).
Dado que la IRC ocurre comúnmente en perros de edad avanzada, que la enfermedad renal es la más común en este tipo de pacientes —con una prevalencia que oscila entre el 0,37-3,74 % en varias poblaciones de perros (Bartges, 2012, Dudley et al., 2017)— y que afecta en distinta medida el funcionamiento de los procesos hemostáticos, el análisis de estos cambios es esencial. El objetivo de este estudio fue evaluar en perros con IRC la hemostasia por medio de diferentes parámetros (TP, APTT, fibrinógeno y plaquetas) y cómo estos se modifican en la insuficiencia renal crónica en sus diferentes estadios.
Materiales y métodos
El estudio se realizó en el Laboratorio de Análisis Clínicos y en la Clínica del Hospital Veterinario de la Facultad de Veterinaria (Udelar). Se llevó a cabo en el período comprendido entre julio de 2019 y julio de 2021. Los procedimientos que involucraron animales contaron con el consentimiento de sus propietarios y bajo la supervisión de los médicos veterinarios tratantes. Todos los procedimientos realizados estuvieron de acuerdo con las normas de bienestar animal en experimentación, bajo protocolo aprobado por la comisión de ética para el uso de animales de experimentación de la Facultad de Veterinaria, Udelar (Exp. N.o 111900-001073-19: CHEA N.o 996/19).
Animales
Se incluyeron en este estudio perros adultos diagnosticados previamente con insuficiencia renal crónica, así como animales clínicamente sanos.
Con estos caninos se conformaron 2 grupos de animales: Grupo IRC, formado por caninos con diagnóstico confirmado de insuficiencia renal crónica (n = 14), y Grupo GC, formado por caninos clínicamente sanos (n = 9). Estos últimos oficiaron como grupo control, y los valores obtenidos se compararon con los rangos de referencia de la Oregon State University (OSU, 2019), utilizados por el Laboratorio de Análisis de Clínicos de la Facultad de Veterinaria.
Criterios de inclusión y anamnesis
Dentro del grupo control, los animales que se incluyeron estaban clínicamente sanos, por lo que no presentaban ninguna alteración ni sintomatología clínica relacionada con la patología estudiada en este trabajo ni ninguna otra al ser evaluados clínicamente y con valores de hemograma, perfil bioquímico hepático y renal dentro de los parámetros fisiológicos para la especie. Integraron este grupo 9 caninos de raza ovejero alemán (4 machos y 5 hembras, de 1 a 15 años).
En el grupo IRC se incluyeron pacientes sin predilección de sexo, raza o edad y con diagnóstico confirmado previamente de insuficiencia renal crónica, con evolución superior a los 15 días (perfil renal con valores de urea sérica ≥ 64,3 mg/dl y creatinina ≥ 1,4 mg/dl, de acuerdo con los criterios de IRIS), análisis clínico y en algunos casos ecográficos. Este grupo quedó conformado por 14 perros (9 hembras y 5 machos, de 2 a 17 años) de diversas razas, así como mestizos.
Diseño experimental
Se evaluó clínicamente a los animales para determinar su estado general a través de un examen objetivo general, así como el respectivo examen particular del aparato urinario en el caso de los animales con IRC. A su vez se evaluó y registró toda la sintomatología que los animales presentaban en el momento de la consulta. En la anamnesis, se incluyó, de forma específica, información respecto a si los animales presentaban sintomatología relacionada con problemas de la hemostasia.
A todos los animales se les realizó la prueba de sangrado en mucosa mediante un corte de 0,5 cm con aguja 21 G en la mucosa del labio superior; la sangre se secó con un papel de filtro por debajo de la incisión para no interferir con la hemostasia primaria. El tiempo de sangrado estuvo determinado por el tiempo transcurrido entre la incisión de la mucosa y el cese del sangrado.
De cada paciente incluido en el estudio se obtuvieron muestras de sangre por venopunción de la vena cefálica con aguja 21 G, en tubos con citrato para el estudio de la crasis sanguínea y tubos con EDTA para la realización del hemograma. Las muestras para la evaluación de crasis fueron las primeras en colocarse en los tubos citratados, para evitar el comienzo de la coagulación. Otra submuestra de sangre se colocó en tubos sin anticoagulante para realizar la valoración del fósforo sérico y el perfil renal (urea y creatinina). Las muestras obtenidas fueron procesadas en el Laboratorio de Análisis Clínicos de Facultad de Veterinaria, Udelar. Con ayuda de los propietarios se recolectó también la primera orina de la mañana de todos los pacientes del Grupo IRC.
Determinación de las variables hemostáticas, hematológicas, bioquímicas y urinarias
Las muestras de sangre para evaluar la crasis fueron centrifugadas por 10 minutos a 4000 g, a temperatura ambiente, se obtuvo plasma citratado, que fue colocado en tubos Eppendorf y freezado hasta el momento de su análisis. En este plasma citratado se determinó el tiempo de protrombina (TP) utilizando Soluplastin (tromboplastina cálcica), APTT (APTTest ellágico) y fibrinógeno (método funcional de Clauss). Las muestras se procesaron en un equipo automatizado COR50 (Wiener Lab, Rosario, Argentina). Para la calibración de las técnicas de fibrinógeno y tiempo de protrombina se utilizaron calibradores y controles (normal y patológico) de la empresa Wiener Lab, Rosario, Argentina).
Los tubos con anticoagulantes EDTA para evaluación del hemograma se analizaron en el contador hematológico (Mythic 18 Vet Hematology Analyzer, Orphée). Paralelamente se realizó un frotis sanguíneo, el cual se coloreó con la técnica de May Grunwald - Giemsa, para el recuento diferencial de los leucocitos, valoración de la morfología celular, así como la valoración de la línea roja y confirmación del conteo plaquetario realizado por el equipo automatizado. Para la calibración de la técnica se utilizaron calibradores (Myt-CAL Vet) y controles (Myt-3D Vet) del laboratorio Orphée, correspondientes a dicho equipo.
Las muestras de sangre para el estudio de la bioquímica sérica fueron centrifugadas por 10 minutos a 4000 g, a temperatura ambiente. El suero fue alicuotado en tubos Eppendorf y almacenados a -20 °C hasta el procesamiento de las muestras; para la determinación de la bioquímica sérica (creatininemia, uremia, así como la proteinuria en orina) se utilizaron reactivos de Wiener Lab Group en un equipo automatizado CB350i Wiener Lab, Rosario, Argentina. Para la calibración de las técnicas se utilizaron calibradores (Aplus) y controles (Standatrol S-E 2 niveles) para bioquímica sérica (normal y patológico) de la empresa Wiener Lab, Rosario, Argentina. Para determinar la proteinuria se utilizó control (Proti U/LCR) y calibrador (Proti U/LCR) de la empresa Wiener Lab, Rosario, Argentina. Los coeficientes de variaciones intra ensayo para todos los controles comerciales y para los metabolitos analizados fueron menores al 10 %. En la orina se realizó la determinación de la densidad urinaria mediante un refractómetro clínico manual y la cuantificación de la proteinuria en un espectrofotómetro automatizado (CB350i).
Análisis estadístico
Los resultados obtenidos se analizaron con el paquete estadístico SAS (Statistical Analysis System). Se verificó la normalidad de los datos por el procedimiento Univariate de dicho paquete estadístico y se realizaron transformaciones logarítmicas en aquellos casos donde los datos no fueran normales.
Las variables se analizaron por el procedimiento mixto incluyendo en el modelo el grupo (sano e insuficiencia renal crónica) como efecto fijo; la edad y sexo se utilizaron como covariables.
Para analizar los efectos del estadio de la enfermedad sobre las variables de respuesta se agruparon los estadios iniciales 1 y 2 (no azotémicos y levemente azotémicos) y los estadios más avanzados de la insuficiencia renal crónica (3 y 4 moderada a severamente azotémicos) utilizando los mismos test estadísticos (excluyendo los animales controles). Se realizó un estudio de correlación de Pearson entre las variables de creatinina/urea y los distintos parámetros de la crasis sanguínea, eritrograma y leucograma para los perros con IRC.
Se reportan las medias y los errores estándares. Valores de P˂0,05 se consideraron significativos y valores entre 0,05 y 0,1 se consideraron tendencia.
Resultados
Las edades de los perros del grupo control oscilaron entre 1 y 15 años, con una media de edad de 7,2 ± 4,3 años, mientras que para el grupo IRC fueron de 2 a 17 años, con una media de edad de 10,2 ± 5,2 años, no hubo diferencias entre los grupos.
Estadificación y sintomatología clínica
De acuerdo con los criterios de clasificación de la IRIS, acorde a los niveles de creatinina sérica, se pudo observar que los animales del grupo IRC se encontraban en distintos estadios, cuatro de ellos en estadio 1, cinco en estadio 2, dos en estadio 3 y tres en estadio 4.
Desde punto de vista clínico los caninos del grupo IRC, en los estadios 2, 3 y 4, presentaron sintomatología asociada al cuadro de insuficiencia renal. Se observó en pacientes en estadio 2 síndrome poliuria-polidipsia, pelaje desmejorado y vómitos aislados; en los estadios 3 y 4, la signología aumenta presentándose además alguno de los siguientes signos: depresión del sensorio, anorexia, pérdida de peso, úlceras en mucosa oral, lesiones en piel, aliento urémico y mucosas anémicas. Cabe señalar que, a pesar de esto, varios de los caninos (12) se encontraban en buen estado y con su patología controlada mediante alimento de prescripción para enfermedad renal o por tratamiento médico. Solo dos de los pacientes (estadio 4) presentaron síntomas asociados a alteraciones en la crasis sanguínea, uno de los perros mostraba hematoquecia, mientras que el otro presentaba petequias.
Determinaciones de laboratorio en animales sanos (GC) y con insuficiencia renal crónica (IRC)
Perfil renal
Al comparar el perfil renal del grupo IRC con el GC, las concentraciones séricas de urea y creatinina tendieron a diferir entre grupos (p = 0,06 y p = 0,058, respectivamente). En el grupo IRC los valores estuvieron por encima del valor de referencia, para ambas variables, mientras que para el GC estuvieron dentro del rango para la especie canina (tabla 1).
Eritrograma
No se encontraron diferencias entre grupos en el recuento de eritrocitos, valor del hematocrito y prueba de amplitud de distribución eritrocitaria. La concentración de Hb, Hb corpuscular media y concentración de Hb corpuscular media fueron menores en el grupo IRC que en los animales control (p = 0,022, p = 0,0001 y p = 0,0001, respectivamente), así como una tendencia a presentar un mayor MCV en el grupo IRC (tabla 1). Si bien no se observó diferencia entre grupos a nivel de los eritrocitos, se presentó anemia y menores concentraciones de Hb en 4 pacientes con insuficiencia renal crónica en los estadios más avanzados, acompañada de menores concentraciones de Hb.
Leucograma
En lo referente al leucograma, no se observó ninguna diferencia significativa entre grupos a nivel de los distintos tipos celulares. Individualmente se pudo observar, dentro del grupo IRC, pacientes con valores alterados: 5 individuos presentaron valores por debajo de los rangos de referencia en el recuento de monocitos y 3 por encima. Se pudo observar también neutrofilia en 3 casos, 2 perros con leucopenia y 2 con leucocitosis.
Parámetros hemostáticos
En la tabla 1 se resumen los parámetros de TP, APPT, fibrinógeno y recuento de plaquetas para ambos grupos. El TP fue menor en el grupo IRC respecto el GC (P = 0,04). La concentración de fibrinógeno fue 3 veces mayor en el grupo IRC que en el GC (µ 498,53 mg/dl y µ 185,32 mg/dl, respectivamente). El resto de las variables hemostáticas no presentaron diferencias. Si bien el TP fue inferior en el grupo IRC, la media en ambos grupos estuvo dentro de los rangos fisiológicos de referencia para dicho parámetro. Dos de los 14 animales del grupo IRC mostraron un número de plaquetas por debajo del rango normal y un perro, valores por encima. En el APPT, a pesar de no encontrarse diferencias significativas entre grupos, se observó una tendencia de las medias a diferir, 9 individuos del grupo IRC presentaron valores por encima del rango fisiológico (valor máximo registrado de 20,6 s). Cabe señalar que uno de los pacientes presentó un APPT tan prolongado que el sistema no pudo medir el tiempo al procesar la muestra (alarma SAT). Para el fibrinógeno los valores estuvieron por encima del límite superior de referencia en 7 de 14 individuos, los valores más altos se registraron en los estadios más avanzados de la IRC. Con respecto al TSM, los valores en ambos grupos estuvieron dentro del rango de referencia, no se encontraron diferencias significativas en las medias reportadas entre el GC y el IRC para este parámetro (1,6 ± 0,19 y 1,9 ± 0,16 minutos, respectivamente).
Tabla 1: Parámetros referidos al perfil renal, eritrograma y crasis sanguínea expresados en media ± error estándar y valor de p en perros con IRC (n = 14) y perros sanos utilizados como control (n = 10)
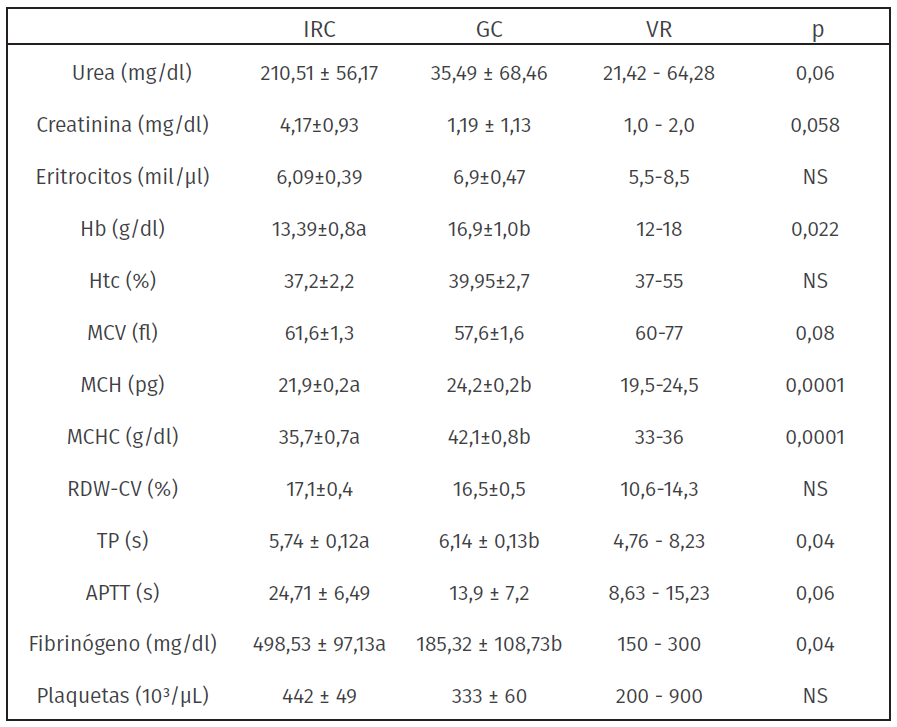
TSM: Tiempo de sangrado en mucosas, TP: tiempo de protrombina, APTT: Tiempo de tromboplastina parcial activada, Hb: Hemoglobina, Htc: Hematocrito, MCV: Volumen corpuscular medio, MCH: Hemoglobina corpuscular media, MCHC: Concentración de hemoglobina corpuscular media, RDW-CV: amplitud de distribución eritrocitaria. a versus b = p<0,05; NS = valores no significativos. (OSU, 2019; Herring & Mc Michael, 2012).
Los resultados obtenidos en las distintas variables estudiadas al reclasificar a los animales del grupo IRC acorde al grado de azotemia se muestran en la tabla 2.
Las concentraciones de urea y creatinina fueron más altas en los estadios avanzados de la enfermedad. Los estadios 3 y 4 también presentaron un mayor TSM y concentraciones de fibrinógeno, no se observaron diferencias significativas a nivel del TP, APTT y plaquetas. Dentro de la línea roja se registraron menores concentraciones de eritrocitos y hemoglobina, así como un menor hematocrito y una tendencia a un mayor MCV en los animales en estadio avanzado, lo cual coincide con los signos de anemia observados a nivel clínico en estos pacientes.
Tabla 2: Variables hemostáticas, renales y del hemograma expresadas en media ± error estándar para los estadios leves y más avanzados de la IRC
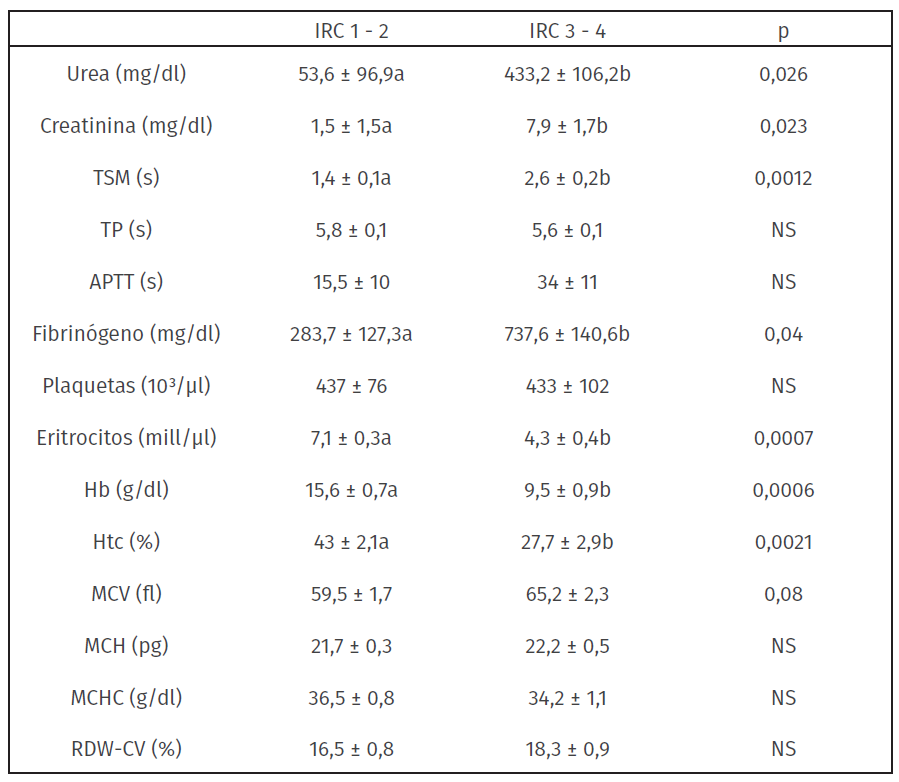
TSM: Tiempo de sangrado en mucosas, TP: tiempo de protrombina, APTT: Tiempo de tromboplastina parcial activada, Hb: Hemoglobina, Htc: Hematocrito, MCV: Volumen corpuscular medio, MCH: Hemoglobina corpuscular media, MCHC: Concentración de hemoglobina corpuscular media, RDW-CV: amplitud de distribución eritrocitaria. a versus b = p<0.05; NS = valores no significativos; IRC 1 - 2 = insuficiencia renal crónica estadio 1 y 2; IRC 3 - 4 = insuficiencia renal crónica estadio 3 y 4.
Asociación entre variables
Se encontró una correlación positiva y alta del TSM con la urea y la creatinina; no se encontraron para el resto de las variables hemostáticas correlaciones significativas a mencionar (tabla 3).
Tabla 3: Coeficiente de correlación de Pearson de las variables creatinina y urea con respecto a las variables del hemostáticas en caninos con IRC (n = 14)
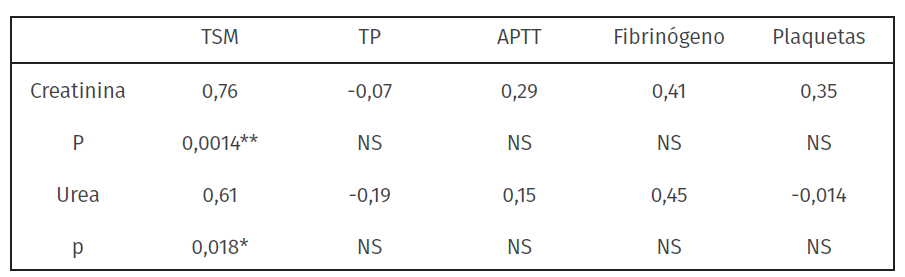
TSM: Tiempo de sangrado en mucosas, TP: tiempo de protrombina, APTT: Tiempo de tromboplastina parcial activada.
A nivel de la línea roja, se observó una correlación negativa importante entre los niveles de creatinina y los eritrocitos, la Hb y el hematocrito (tabla 4). No se encontró correlación significativa entre los niveles de urea y creatinina con el leucograma de pacientes con IRC.
Tabla 4: Coeficiente de correlación de Pearson de las variables creatinina y urea con respecto a las variables del eritrograma en caninos con IRC (n = 14)
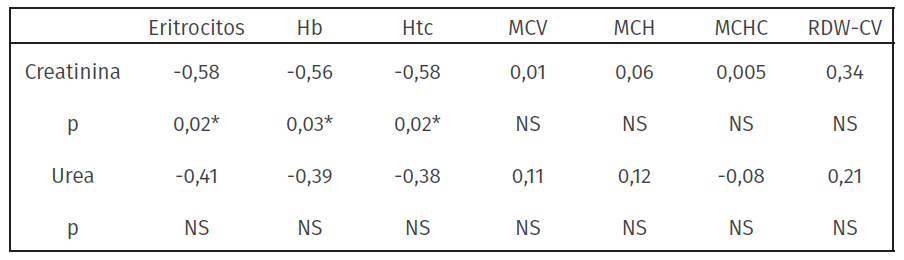
Hb: Hemoglobina, Htc: Hematocrito, MCV: Volumen corpuscular medio, MCH: Hemoglobina corpuscular media, MCHC: Concentración de hemoglobina corpuscular media, RDW-CV: amplitud de distribución eritrocitaria.
Discusión y conclusión
En nuestro conocimiento este es el primer trabajo en nuestro país que aborda el funcionamiento del sistema hemostático canino y cómo este se ve afectado por la IRC, patología de frecuente aparición en la clínica de pequeños animales.
Los datos de los síntomas clínicos observados en este trabajo coinciden con lo reportado por otros autores (IRIS, 2019b; Segev, 2022). En estadios iniciales (1 y 2) observamos nula o escasa sintomatología (poliuria-polidipsia), mientras que los pacientes del grupo IRC con niveles más altos de azotemia (estadio 3 y 4) presentaron síntomas más evidentes. De estos últimos solo dos individuos (pertenecientes al estadio 4) presentaron síntomas asociados a problemas de hemostasia (hematoquecia y presencia de petequias a nivel de piel). Esto coincide con lo descripto por Polzin (2011), que en etapas finales de la enfermedad es común la aparición de complicaciones gastrointestinales (apetito reducido, náuseas, vómitos, estomatitis urémica, halitosis, hemorragia gastrointestinal y colitis hemorrágica). Así mismo, Pedraza Castillo (2012) observó presencia de sangre oculta en materia fecal en caninos con IRC en estadios 2, 3 y 4, indicativo de sangrado gastrointestinal. Bartges (2012) reporta que muchos pacientes con IRC muestran síntomas de la enfermedad a nivel clínico y a nivel bioquímico (azotemia, acidosis metabólica e hiperfosfatemia), además de anemia no regenerativa, dislipemia, hipoalbuminemia e infección del tracto urinario.
En pacientes con IRC es frecuente observar la presencia de anemia normocítica, normocrómica y no regenerativa, sobre todo en perros y gatos en estadio 3 o 4. La causa de dicha anemia es multifactorial e incluye disminución de la producción de eritropoyetina por parte del riñón; disminución de la vida útil de los eritrocitos; desequilibrios nutricionales, debido a la hiporexia/anorexia, y pérdida de sangre, debido a gastroenteritis urémica (Polzin, 2011; Bartges, 2012). Adicionalmente, la anemia contribuye de manera importante a la falla de las plaquetas, ya que las células rojas mejoran su función (Casserly & Dember, 2003). Es sabido que, a medida que la capacidad de filtración y funcionalidad del riñón decae, incrementa el porcentaje de pacientes con anemia y hematocrito bajo, con la consiguiente disminución de hemoglobina. Esta situación se ve agravada a medida que avanzan los estadios de la IRC y presenta una fuerte correlación con el aumento del tiempo de sangrado (Fernández et al., 1985; Gäckler et al., 2019; McClellan et al., 2004). Estos resultados son consistentes con nuestro estudio, ya que en los pacientes con creatinina aumentada se pudo observar una disminución en los niveles de eritrocitos, hematocrito y hemoglobina. En este mismo sentido, Gonçalves et al. (2020) demostraron que caninos con IRC avanzada (estadios 3 y 4) presentaban hematocritos más bajos y menores concentraciones de hemoglobina al compararlos con individuos sanos. En lo referente al eritrograma, no observamos diferencias en el recuento total de eritrocitos entre el grupo IRC y el GC, pero sí menores concentraciones de hemoglobina, MCH y MCHC en el grupo IRC. Esta discordancia con lo descripto en la bibliografía puede deberse al menor número de pacientes en estadios avanzados incluidos en nuestro trabajo. A nivel de la línea roja, se acentuaron las diferencias al comparar a los animales en etapas tempranas de la enfermedad (estadio 1 y 2) con los animales en estadios avanzados (3 y 4), se observaron diferencias significativas a nivel de la cantidad de eritrocitos, hematocrito y la concentración de hemoglobina.
Con relación a los distintos parámetros de la crasis sanguínea estudiados pudimos observar cómo estos se veían alterados en pacientes con IRC y dichas variaciones se acentuaban en estadios graves de la enfermedad. Las variables más afectadas fueron el nivel de fibrinógeno, que aumentó su concentración plasmática, y una disminución en el TP en pacientes con IRC en estadios avanzados. Dudley et al. (2017) reportaron que la concentración de fibrinógeno fue
mayor en perros con IRC en estadio 3 y 4, respecto del grupo control, si bien no encontraron diferencias en el TP. Por otro lado, Donahue et al. (2011) constataron concentraciones más altas de fibrinógeno en perros con falla renal y perros con nefropatía perdedora de proteínas (NPP) y TP más cortos en los animales con NPP respecto a los controles. Los resultados discordantes entre estudios al TP pueden deberse a las diferentes metodologías de laboratorio empleadas, ya que estos trabajos utilizan instrumento de detección de coágulos mecánico automatizado y tromboelastografía, diferentes al cuagulómetro automático utilizado en nuestro trabajo.
Al comparar animales con IRC leve (1 y 2) versus los estadios más avanzados (3 y 4) no encontramos diferencias en el TP, si bien la concentración de fibrinógeno fue de aproximadamente casi tres veces más en los pacientes graves (estadio 4). En un trabajo de tesis realizado en Brasil con 39 caninos (Pedraza Castillo, 2012), clasificados en controles y 3 estadios (2, 3 y 4) de la insuficiencia renal, no se observaron diferencias para los parámetros TP y concentración plasmática de fibrinógeno. No obstante, sí reporta un mayor APTT en animales en el estadio 2 con respecto a los animales del estadio 4, pero sin diferencia con los otros estadios o animales sanos (Pedraza Castillo, 2012).
En humanos con enfermedad renal en etapa terminal se reportó un aumento del fibrinógeno (Kotliarova et al., 2011) y tiempo de coagulación (Nunns et al., 2017). Por otro lado, Gäckler et al. (2019), al comparar pacientes en hemodiálisis, diálisis peritoneal, pacientes con enfermedad renal crónica en estadio 5 (ERCE5) y pacientes sanos, no pudieron constatar diferencias significativas para TP y APTT en ningún grupo, observaron únicamente un aumento significativo del fibrinógeno en pacientes sometidos a diálisis peritoneal.
Estos hallazgos, a nivel hemostático, son consistentes con trabajos en caninos y en humanos, en los que se reporta tendencia al sangrado secundario, alteraciones en la funcionalidad de las plaquetas o alteraciones en la cascada de la coagulación que pueden llevar a sangrado o trombopatías vinculados a la uremia y acúmulo de toxinas urémicas derivadas de proteínas (Brassard et al., 1994; Dudley et al., 2017; Lutz et al., 2014; Polzin, 2011). La disfunción plaquetaria en pacientes con ER avanzada, tanto en caninos como en humanos, por consecuencia de uremias moderadas a graves, puede presentarse debido a fallas en la secreción de gránulos plaquetarios, cambios en la dinámica del calcio citoplasmático, anomalías plaquetarias intrínsecas, déficit en la interacción entre plaquetas y pared de los vasos sanguíneos, y menor adhesión y agregación plaquetaria (Kaw & Malhotra, 2006; Sohal et al., 2006; Thekkedath et al., 2006).
A nivel de plaquetas no se observaron diferencias al comparar animales sanos con enfermos ni al comparar los distintos estadios de IRC. En acuerdo con nuestros resultados, Donahue et al. (2011) no reportaron diferencias para este parámetro en perros con IRC y nefropatía perdedora de proteína respecto a los perros sanos. Estos resultados difieren en parte con lo observado por Pedraza Castillo (2012) en perros en estadio 2 o con el aumento plaquetario registrado por McBride et al. (2019) en caninos con insuficiencia renal aguda en estadio 3 al 5 (creatinina ˃ 2,6 mg/dl). En contraposición, Dudley et al. (2017) observaron una tendencia a un menor conteo plaquetario en perros con IRC. Resultados similares son reportados en humanos observándose una disminución significativa del recuento plaquetario en pacientes con enfermedad renal terminal (Kotliarova et al., 2011) o en individuos con ERCE5 (Gäckler et al., 2019). Estudios ex vivo en perros mostraron alteraciones en la agregación plaquetaria en presencia de uremia, lo que sugiere una alteración funcional más que cuantitativa de las plaquetas (Mischke & Schulze, 2004).
Con respecto al tiempo de sangrado en nuestro estudio no se constataron diferencias entre animales sanos y enfermos. Sin embargo, al comparar animales en etapas tempranas de la IRC con animales en etapas avanzadas, sí se evidencia un mayor TSM en los estadios 3 y 4. En caninos con falla renal inducida, Brassard et al. (1994) observaron una fuerte correlación entre el aumento del TSM y el aumento de sustancias nitrogenadas en sangre. Esto mismo puede verse en perros con azotemia severa, donde el tiempo medio de este parámetro es significativamente superior (Jergens et al., 1987). Se ha observado también prolongación del TSM en humanos con uremia (Gralnick et al., 1988) y en pacientes con insuficiencia renal crónica sometidos a diálisis (Fernández et al., 1985). Estos trabajos son consistentes con la fuerte correlación positiva observada en nuestro estudio entre el aumento de los niveles de urea y la prolongación del TSM.
En concordancia a lo reportado por Pedraza Castillo (2012), no encontramos ninguna correlación significativa entre los niveles de urea y creatinina con los parámetros hemostáticos de laboratorio (TP, APTT, fibrinógeno y plaquetas). Resultados similares son observados por Ventura et al. (2013), quienes no encontraron correlación significativa entre los niveles de creatinina y urea y dichos parámetros, concluyendo además, en este caso, que no se pueden utilizar estos parámetros como valores predictivos del sangrado en perros azotémicos. Sin embargo, en nuestro estudio observamos una fuerte correlación de los niveles de urea y creatinina con la prueba del TSM realizada en la revisación clínica. En este mismo sentido Ventura et al. (2013) sí observaron una correlación significativa entre el TSM en caninos con respecto al aumento de creatinina y urea.
En conclusión, podemos decir que los perros con insuficiencia renal crónica presentan un menor tiempo de protrombina acompañado de un aumento en los niveles de fibrinógeno con respecto a los animales sanos estudiados. Las alteraciones más notorias de los parámetros de la crasis sanguínea se observaron en los pacientes en estadio avanzados de la IRC. Por lo que el estudio de estas variables en pacientes caninos con diagnóstico de IRC es fundamental para el tratamiento de estas alteraciones.
Agradecimientos
A los tenedores y colegas que colaboraron al participar del estudio con sus mascotas o pacientes. A los integrantes del laboratorio de análisis clínicos de la FVET-Udelar, por facilitar sus recursos humanos y materiales para la investigación y concreción de este trabajo.
Referencias
Agarwal, R., & Light, R. P. (2011). Patterns and prognostic value of total and differential leukocyte count in chronic kidney disease. Clinical Journal of the American Society of Nephrology, 6(6), 1393-1399.
Arai, Y., Kanda, E., Iimori, S., Naito, S., Noda, Y., Sasaki, S., … Uchida, S. (2018). Low white blood cell count is independently associated with chronic kidney disease progression in the elderly: the CKD-ROUTE study. Clinical and Experimental Nephrology, 22(2), 291-298.
Bartges, J., & Polzin, D. (2011). Nephrology and urology of small animals (Eds.). Ames: John Wiley & Sons.
Bartges, J. W. (2012). Chronic kidney disease in dogs and cats. Veterinary Clinics of North American: Small Animal Practice, 42(4), 669-692.
Brassard, J. A., Meyers, K. M., Person, M., & Dhein, C. R. (1994). Experimentally induced renal failure in the dog as an animal model of uremic bleeding. Journal of Laboratory and Clinical Medicine, 124(1), 48-54.
Brown, S.A. (2007). Management of chronic kidney disease. En Manual of canine and Feline Nephrology and urology (2.ª ed., pp. 223-230). Gloucester: BSAVA.
Burkholder, W. J. (2000). Dietary considerations for dogs and cats with renal disease. Journal of the American Veterinary Medical Association, 216(11), 1730-1734.
Casonato, A., Pontara, E., Vertolli, U. P., Steffan, A., Durante, C., De Marco, L., … Girolami, A. (2001). Plasma and platelet von Willebrand factor abnormalities in patients with uremia: lack of correlation with uremic bleeding. Clinical and Applied Thrombosis/Hemostasis, 7(2), 81-86.
Casserly, L. F., & Dember, L. M. (2003). Thrombosis in end-stage renal disease. Seminars in Dialysis, 16(3), 245-256.
Citak, A., Emre, S., Sâirin, A., Bilge, I., & Nayir, A. (2000). Hemostatic problems and thromboembolic complications in nephrotic children. Pediatric Nephrology, 14(2), 138-142.
Cortadellas, O. (2010). Manual de nefrología y urología clínica canina y felina. Zaragoza: Servet.
Donahue, S. M., Brooks, M., & Otto, C. M. (2011). Examination of hemostatic parameters to detect hypercoagulability in dogs with severe protein-losing nephropathy. Journal of Veterinary Emergency and Critical Care, 21(4), 346-355.
Dudley, A., Byron, J. K., Burkhard, M. J., Warry, E., & Guillaumin, J. (2017). Comparison of platelet function and viscoelastic test results between healthy dogs and dogs with naturally occurring chronic kidney disease. American Journal of Veterinary Research, 78(5), 589-600.
Fernández, F., Goudable, C., Sie, P., Ton-That, H., Durand, D., … Boneu, B. (1985). Low haematocrit and prolonged bleeding time in uraemic patients: effect of red cell transfusions. British Journal of Haematology, 59(1), 139-148.
Fischer, K. G. (2007). Essentials of anticoagulation in hemodialysis. Hemodialysis International, 11(2), 178-189.
Gäckler, A., Rohn, H., Lisman, T., Benkö, T., Witzke, O., Kribben, A., & Saner, F. H. (2019). Evaluation of hemostasis in patients with end-stage renal disease. PloS one, 14(2), e0212237.
Gonçalves, D.S., Silvano, S., Geraldes, S.S., Duarte, R.C.F., Carvalho, M.G., Guimarães-Okamoto, P.T.C., & Takahira, R.K. (2020). Thrombin generation and thromboelastometry tests in dogs with chronic kidney disease. Pesquisa Veterinária Brasileira, 40(2),113-120.
Gralnick, H. R., McKeown, L. P., Williams, S. B., Shafer, B. C., & Pierce, L. (1988). Plasma and platelet von Willebrand factor defects in uremia. The American Journal of Medicine, 85(6), 806-810.
Green, R. A. (1988). Pathophysiology of antithrombin III deficiency. Veterinary Clinics of North American: Small Animal Practice, 18(1), 95-104.
Hermosín Alcalde, A., Pereira Jiménez, E., & Loro Padilla, M.D. (2017). Complicaciones hematológicas en la insuficiencia renal crónica. Revista Electrónica de PortalesMedicos.com, 12. Recuperado de https://www.revista-portalesmedicos.com/revista-medica/complicaciones-hematologicas-insuficiencia-renal-cronica/
International Renal Interest Society. (2019a). Diagnosing, Staging, and Treating Chronic Kidney Disease in Dogs and Cats. Recuperado de http://www.iris-kidney.com/guidelines/staging.html
International Renal Interest Society. (2019b). IRIS staging of CKD. Recuperado de http://www.iris-kidney.com/guidelines/staging.html
Jergens, A. E., Turrentine, M. A., Kraus, K. H., & Johnson, G. S. (1987). Buccal mucosa bleeding times of healthy dogs and of dogs in various pathologic states, including thrombocytopenia, uremia, and von Willebrand's disease. American Journal of Veterinary Research, 48(9), 1337-1342.
Kaw, D., & Malhotra, D. (2006). Platelet dysfunction and end-stage renal disease. Seminars in Dialysis, 19(4), 317-322.
Kim, S. M., & Kim, H. W. (2014). Relative lymphocyte count as a marker of progression of chronic kidney disease. International Urology and Nephrology, 46(7), 1395-1401.
Kogika, M. M., Lustoza, M. D., Hagiwara, M. K., Caragelasco, D. S., Martorelli, C. R., & Mori, C. S. (2015). Evaluation of oxidative stress in the anemia of dogs with chronic kidney disease. Veterinary Clinical Pathology, 44(1), 70-78.
Kotliarova, G.V., Kozlovskaia, N.L., Lashutin, S.V., Komiagin, I.V., Shakhnova, E.A., Dobromyslov, I.A., … Nesterova, S.G. (2011). Comparative characteristics of hemostasis system in patients with end stage renal disease admitted for urgent and elective hemodialysis. Terapevticheskii Arkhiv, 83(6), 36-41.
Lutz, J., Menke, J., Sollinger, D., Schinzel, H., & Thürmel, K. (2014). Haemostasis in chronic kidney disease. Nephrology Dialysis Transplantation, 29(1), 29-40.
McBride, D., Jepson, R. E., Cortellini, S., & Chan, D. L. (2019). Primary hemostatic function in dogs with acute kidney injury. Journal of Veterinary Internal Medicine, 33(5), 2029-2036.
McClellan, W., Aronoff, S. L., Bolton, W. K., Hood, S., Lorber, D. L., Tang, K. L., … Leiserowitz, M. (2004). The prevalence of anemia in patients with chronic kidney disease. Current Medical Research and Opinion, 20(9), 1501-1510.
Mischke, R., & Schulze, U. (2004). Studies on platelet aggregation using the Born method in normal and uraemic dogs. The Veterinary Journal, 168(3), 270-275.
Naumnik, B., Borawski, J., Pawlak, K., & Myśliwiec, M. (2002). Effect of hemodialysis on plasma levels of vascular endothelial markers. Clinical and Applied Thrombosis/Hemostasis, 8(3), 245-250.
Nunns G.R., Moore E.E., Chapman M.P., Moore H.B., Stettler G.R., Peltz E., … Sauaia A. (2017). The hypercoagulability paradox of chronic kidney disease: The role of fibrinogen. The American Journal of Surgery, 214(6), 1215-1218.
OSU Oregon State University. (2019). Biochemestry & Hematology reference intervals. Recuperado de https://vetmed.oregonstate.edu/diagnostic/resources/clinical-pathology-reference-intervals
Pawlak, K., Borawski, J., Naumnik, B., & Mysliwiec, M. (2003). Relationship between oxidative stress and extrinsic coagulation pathway in haemodialyzed patients. Thrombosis Research, 109(5-6), 247-251.
Pedraza Castillo, L.N. (2012). Variáveis da hemostasia sanguínea primária e secundária na doença renal crônica canina (Tese mestrado). Faculdade de Ciências Agrárias e Veterinárias, Unesp, São Paulo. Recuperado de https://repositorio.unesp.br/handle/11449/88984
Polzin, D. J. (2011). Chronic kidney disease in small animals. Veterinary Clinics of North America: Small Animal Practice, 41(1), 15-30.
Segev, G. (2022). Differentiation between Acute Kidney Injury and chronic kidney disease. IRIS. Recuperado de http://www.iris-kidney.com/education/differentiation_acute_kidney_injury_chronic_kidney_disease.html
Sohal, A. S., Gangji, A. S., Crowther, M. A., & Treleaven, D. (2006). Uremic bleeding: pathophysiology and clinical risk factors. Thrombosis Research, 118(3), 417-422.
Takahira, R.K. (2015). Hemostasia Normal. En M.M. Jericó, J.P. de A. Neto & M.M. Kogika, Tratado de medicina interna de cáes e gatos (pp. 1870-1875). Rio de Janeiro: Guanabara Koogan.
Thekkedath, U. R., Chirananthavat, T., Leypoldt, J. K., Cheung, A. K., & Mohammad, S. F. (2006). Elevated fibrinogen fragment levels in uremic plasma inhibit platelet function and expression of glycoprotein IIb-IIIa. American Journal of Hematology, 81(12), 915-926.
Ventura, F. V. C., De Oliveira Conrado, F., Hlavac, N., Oliveira, S. T., Mattoso, C. R. S., & González, F. H. D. (2013). Alterações da hemostasia primária em cães azotêmicos. Acta Scientiae Veterinariae, 41(1), 1-6.
Disponibilidad de datos
El conjunto de datos que apoyan los resultados de este estudio no se encuentra disponible.
Nota del editor
La editora Cecilia Cajarville aprobó este artículo.
Nota de contribución
Conceptualización, 2. Curación de datos, 3. Análisis formal, 4. Adquisición de financiación, 5. Investigación, 6. Metodología, 7. Administración del proyecto, 8. Escritura - borrador original, 9. Escritura - revisión y edición.
César Hernández ha contribuido en 1, 2, 3, 5, 6, 7, 8 y 9. Fernando Fumagalli ha contribuido en 2, 3, 6 y 9. Claudia Della Cella ha contribuido en 1, 6 y 9. Paula Pessina ha contribuido en 1, 4, 6, 7 y 9.